WILLIAM G. TELFORD, NATIONAL CANCER INSTITUTE; ELIZABETH ILLY AND HÅKAN KARLSSON, COBOLT AB; AND PRASHANT PRABHAT, SEMROCK INC.
在生命科学领域,流式细胞仪是用于临床医学和基础研究的一项关键技术。流式细胞仪使用激光,激光以流体动力学的方式聚焦在单细胞和光子检测器(通常是光电倍增管)上,快速分析大量细胞的各种物理特性。
这项技术使得免疫学得以深入研究,表征了正常免疫系统内数以十记的细胞类型。通过使用单克隆抗体有针对性的标记免疫细胞的表面上的特定蛋白质受体;抗体被耦合到荧光标记时,我们可以选择正确的激光波长在细胞表面检测到抗体,从而实现各种自身免疫性疾病和疾病状况快速诊断。
理论上,有数以千计荧光探针可以用于流式细胞仪。其中一些可以连接到抗体或者其他蛋白质之上,可以标记细胞表面上的特异性标志物。此外,包含可表达的荧光蛋白(如GFP)可用于检测基因表达的细胞中。荧光传感器可被用于测量细胞的健康状态和功能,包括细胞膜的完整性和电势,线粒体功能,钙离子浓度和DNA含量;这些都是对于基本细胞生物学的研究很重要的指示。
但是在今天上文提及的荧光探针仅仅有一小部分在流式细胞仪中是经常使用的,这是主要因为传统的流式细胞仪使用的是氩离子激光器,而它能提供的波长有限,这也限制了波长的选择。
而二极管泵浦固态(DPSS)激光器技术的最新进展使得流式细胞仪可用的波长增加。流式细胞仪内的DPSS 532和561 nm激光正在变得越来越普遍,使得生物医学领域的研究者们把眼光投向了绿色或黄色激光的激发荧光探针。但是在黄色(561 nm)和红色的氦氖或者二极管激光器(630到640 nm)之间的空白很难填补。
当然氦氖激光器发出的橘色594 nm的激光在某些时候是可以使用的,但是过低的功率阻碍了它与流式细胞仪的集成。虽然共焦显微镜中已经开始使用橘色的氦氖激光器,从而可以使用显微镜观测橘色激发荧光探针;但是流式细胞仪始终无法集成这些模块。由于有相当数目的荧光探针-包括一些最新研制出来的可表达荧光蛋白-处于590~595 nm的激发波段之间。如何让流式细胞仪使用上橘色的激光是流式细胞仪激发能力的最后一个空白。
几家激光器制造商最近开发了适合于荧光分析的激光器模块。比如波长为594 nm Cobolt Mambo激光器,功率是25,50和100 mW,远高于流式细胞仪所需的最小功率。

图1.会在流式细胞仪中频繁使用的橙色激光器,这是波长为594 nm Cobolt Mambo激光器。
这种单模DPSS激光器在苛刻的荧光分析的应用中具有特别的吸引力,这样的应用有流式细胞仪。因为它提供非常良好的功率稳定性,非常低强度噪声,均方根值小于0.3%,和一个近乎完美的TEM00模,M
2 <1.1的低发散光束,这都是流式细胞仪所需的性能。
激光是基于专有的周期性极化磷酸钛氧钾(PPKTP)技术构造的,以期获得最佳的灵活性和效率的混合设计。此外,激光为了相当的强健性使用了专有HTCure技术,制造成全密封和紧凑型。其他一些厂商,比如Spectra-Physics Lasers Div.,Calif.和MPB Communications Inc. of Montreal也有橙色的激光。
图2是用594 nm激光器模块的流式细胞仪。一台BD Biosciences LSR II的流式细胞仪集成了Cobolt Mambo 50 mW的模块。实验用的是使用耦合到几个荧光探针之一的抗体,用细胞表面受体CD44标记小鼠淋巴瘤细胞(EL4)。Texas Red一种低分子量荧光分子,亮度强,具有低自体荧光背景。可以很好的与抗体结合,是用于免疫检测的极好的荧光染料。
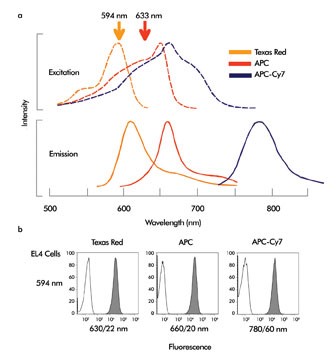
图2,(a)荧光染料Texas Red、别藻蓝蛋白(APC)和APC-Cy7的激发和发射光谱,标记了使用的594和633 nm的波长。(b)用Texas Red、别藻蓝蛋白(APC)和APC-Cy7标记的EL4小鼠淋巴瘤细胞和抗CD44的抗体结合。未着色的峰代表未标记的细胞,着色的峰代表了标记的细胞。
如图2a中所示,Texas Red被594 nm波长的激光完美的激发。这也是荧光显微镜中常用的荧光探针(因为汞灯的577 nm谱线),但是在这个波长由于还没有可用的流式细胞仪所以还不是很常见。
而594 nm波长的模块可以很好的激发这种探针。Invitrogen of Carlsbad公司的Texas Red替代品Alexa Fluor 594具有和Texas Red相媲美的激发和发射特性,但是更加明亮和光稳定,同时也可以在594 nm激发。别藻蓝蛋白(APC)和其共轭串联染料APC-Cy7传统上是由红色氦氖和二极管激光源激发,激发光谱如图2a所示。但是,他们同样可以使用594 nm的激光激发,并且可以使用橘色激光结合Texas Red进行多色分析。
Texas Red,APC和APC-Cy7的适合于偶联到抗体和靶受体的免疫标记。荧光蛋白,第二类荧光探针,实际上是作为可编码基因插入目的细胞。当细胞的基因转录/翻译机制表达了蛋白质,使用适当的激光波长就可以激发它发出荧光。这些探针是用于基因表达的理想标记,并且可以用于各种其他任务,因为荧光探针的内源表达是理想的。
GFP,最有名的标志物,可以用我们非常熟悉的488 nm激发。然而,最近科研工作者已经研发出了各种激发波长位于绿色到红色范围内的荧光蛋白。波长最长的红色荧光蛋白包括mPlum,TagFP635(学名mKate)和TurboFP635(学名Katushka)(图3a)。这些蛋白需要的激发波长大于488 nm,但小于红色氦氖或二极管的波长。红色的激光对这些蛋白的激发效率很差,而594 nm波长的激光提供了这三种蛋白完美的激发效率。
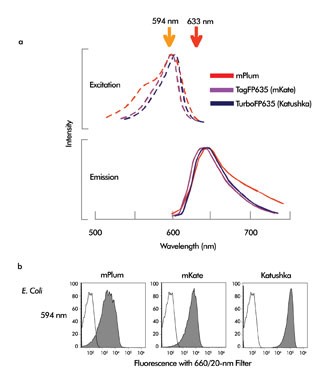
图3,(a)荧光蛋白mPlum, TagFP635 (mKate) 和TurboFP635 (Katushka)的激发和发射光谱。我们标记了594和633 nm。(b)SP2/0细胞稳定转染并表达mPlum,TagFP635或TurboFP635。
胞稳定转染并表达mPlum,TagFP635或TurboFP635。未着色的峰代表未标记的细胞,着色的峰代表了标记的细胞。
如果有适当波长的激光的话,其他各种橘色荧光探针也可以用于流式细胞仪。一个与之相关的应用是将细胞稳定的标记之后注射到实验动物的体内,再进行探测。来自于Invitrogen的CellTracker Red就是一个类似的荧光探针,它需要橘色激光激发。事实上,由于氦氖和二极管激光器无法提供这个探针所需要的激发波长,我们在试验中只能采用594 nm的激光。
对于研究人员和仪器制造商而言,采用橘色这样的新的激发波长,适用的滤光片也是至关重要的。光学滤光片必须为特定的激光波长设计,同时在最大化荧光仪器的吞吐量,灵敏度和对比度中发挥着重要的作用。
硬镀膜滤光片可以达到荧光滤光片所需要的高边缘陡度,在透过波段的高传输和阻止波段的高截止。图4是Semrock公司为594 nm滤光片所设计的硬镀膜滤光片的光谱。流式细胞仪内日益复杂的多色和多参数测定需要同时进行多个激光线和各种颜色的密集发射信号分离。
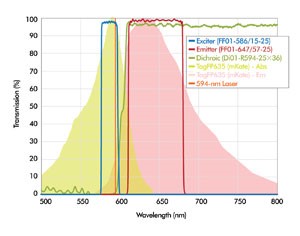
图4. Semrock公司的LF594-A荧光滤光片组的光谱,适用于594 nm激光激发的荧光。图上同时标识了TagFP635(mKate)荧光团的发射与激发光谱。
Semrock还为包括594 nm激光在内的高达六个波段设计了多路滤光片,称之为LaserMUX。其可以结合多个激光束,同时具有超低的损失。这样的滤光片可以促进橘色激光加入到以流式细胞仪为代表的荧光分析仪器内。
总而言之,这些数据显示594 nm波长激光的加入会提高流式细胞仪对于细胞的分析能力。这个波长的激光填补了常见的561 nm激光和红色激光之间的空白。添加此波长的流式细胞仪就能够激发几乎任何可见的荧光探针。
References
W.G. Telford (2004). Small lasers in flow cytometry. T.S. Hawley and R.G. Hawley, eds. Methods in Molecular Biology, Vol. 263. London, Humana Press, pp. 399-418.
W.G. Telford and C.R. Hubert Jr. (2006). Solid-state lasers expand flow cytometry probe library. Biophotonics Intl, Vol. 13, February 2006, pp. 50-53.
S.P. Perfetto and M. Roederer (2007). Increased immunofluorescence sensitivity using 532-nm excitation. Cytometry Part A, Vol. 71A, pp. 73-79.
W.G. Telford et al (2005). DPSS yellow-green 561-nm lasers for improved fluorochrome detection by flow cytometry. Cytometry Part A, Vol. 68A, pp. 36-44.
V.V. Verkhusha and K.A. Lukyanov (2004). The molecular properties and applications of Anthozoa fluorescent proteins and chromoproteins. Nature Biotechnol, Vol. 22, pp. 289-296.
D.M. Chudakov et al (2005). Fluorescent proteins as a toolkit for in vivo imaging. Trends Biotechnol, Vol. 23, pp. 605-613.
N.C. Shaner et al (2004). Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent proteins. Nature Biotechnol, Vol. 22, pp. 1567-1572.
V. Kapoor et al (2007). New lasers for flow cytometry: Filling the gaps. Nature Methods 4, pp. 678-679.
(翻译:北京鼎信优威光子科技有限公司 汪 阳 博士)



