激光与光学增强的光遗传学研究
Niten Olofsson, Iakovos Lazaridis, Konstantinos Meletis and Marie Carlén, Karolinska Institutet, and Ulf Tingström and Håkan Karlsson, Cobolt SE本文是为光遗传学研究选择合适的光源和光纤元件的指南,同时还附有光遗传学对于啮齿动物的行为的影响。利用激光和光学器件的光遗传学研究仅处于起步阶段。在未来的十年光遗传学的研究中,我们可以期待研究人员发现人类大脑的很多内在秘密,同时找到一些最难攻克的精神障碍和疾病的治疗方法,来帮助我们过上更好的生活。
光遗传学的基础是可以在神经元内表达的光活化分子(一般称为视蛋白,图1)的发现。科学家可以用光在大脑正常工作的时间尺度上操作光敏神经元,这样的操作在时间和空间维度上都可以达到非常高的精度。用于光遗传学的视蛋白研发结果可谓突飞猛进,许许多多新型的和急剧改性的视蛋白在稳步实用,这其中也包括很多适用于猴子或者人类的视蛋白。
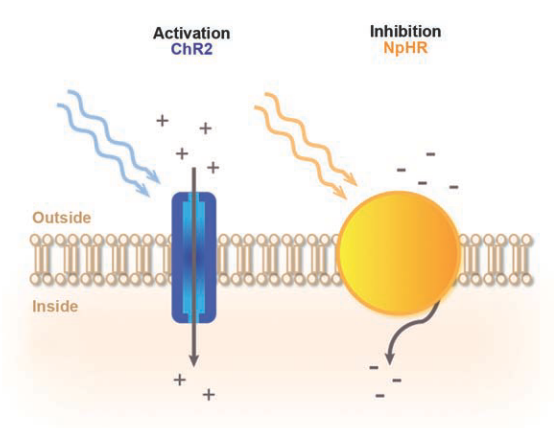
图1.光控调节神经活动的原理。当蓝光照射时常用的激活视蛋白的ChR2允许正离子进入神经元细胞,导致神经元细胞膜的去极化,并产生动作电位。与之相反,用黄光照射最常用的抑制视蛋白NpHR会导致负离子进入神经元细胞,导致神经元细胞的极化和动作电位引发被抑制。
光遗传学的快速发展和多学科性质对于从事其中的科学家是一个重要的挑战。尤其是对于从业者而言针对特定的实验确定适当的光源与光纤组合更是一项艰巨的任务。Cobolt AB和位于斯德哥尔摩的卡罗林斯卡医学院的Marie Carlén和Konstantinos Meletis合作,推出了一系列对于用户友好的激光套件。
光遗传学套件光遗传学中试验中操作活体动物的光源是几乎全是激光。激光是平行的光束,具有非常低的发散,可以有效集成到典型直径为50~300μm的光纤之中。许多光遗传学实验中,我们可以使用一种视蛋白和单侧光操作(即在一个半球)感兴趣的神经元细胞。
为了满足光遗传学实验要求,我们精心设计了三种不同的配置:具有一个光纤操作头的单线激光;一个平台上的两束激光耦合到一个光纤操作头之中;或两束激光分别射入光纤操作头之中,适用于带熔锥型光纤的二合一组合。激光的输出功率为100 mW可调,波长为473,561,594和638 nm,其中波长为561和594nm的激光器是带有调制器或快门的二极管泵浦固态(DPSS)激光器。

图2.用于把光纤植入大脑的插芯。
一般在试验中会考虑的因素包括光纤直径以及如何把光纤插入大脑。将较短的光纤放在保护套中然后再植入大脑是一个可行的方案(图2)。在实验中,较长的光纤插入保护套中,这要求短光纤和长光纤之间有完美的表面接触。而套管引导技术可以在实验期间让更连续,更长的光纤直接植入大脑。管引导技术中光纤的末部连接到一个连接器,与激光器的操纵器(例如,SMA或FC)连接。
更复杂的光遗传学实验需要两个不同波长的光,来实现双侧刺激(大脑两半球)和自由运动的动物。目前主要用两种方法实现对两种不同的波长光的传输。第一种方案中,我们将两个光束定向,再使用无缆线式光学器件耦合到光纤操作器里面。单个光纤耦合到激光器里面,但是如果需要的话可以分成两束。第二种策略避免了无缆线式光学器件,两束激光都分别直接射入光纤。这两条光纤都连接到激光器,需要时可融合成一条光纤。如果试验中需要动物自由运动,同时不希望扭曲和转动光纤,可以添加一个旋转接头。

图3.具有分裂光纤末端和一个旋转接头的光纤和与其连接的激光组件。
光遗传学激光如何在实验中让研究的脑区域有足够的光强,同时也不会过曝光和造成大脑损伤一直是光遗传学的一个巨大挑战。试验中通常使用的功率密度为1至10 mW/mm
2。但是随着视蛋白工艺的进展,视蛋白的光敏感度不断增加,操作视蛋白需要的光强也在慢慢降低。光遗传学试验中的激光选择相当微妙,有几个参数必须谨慎考虑。
首先,选择合适的视蛋白之后,必须选择和视蛋白的灵敏度相匹配的输出波长激光。目前,最常用的波长为473,532,561,594和638纳米。
第二,激光功率必须大到能够成功的激活视蛋白。因此,激光功率必须考虑到光纤传输中的种种损耗。功率也必须是可调的,因为实验所需的光强随着在不同动物体内程度的视蛋白表达程度的不同相差很大。可调功率也是避免过度曝光造成组织损伤的需要。典型的可调节范围应该是从20 mW到额定的最大功率100 mW。
第三个重要的参数是随着时间不变的功率稳定性。因为实验可以运行几个小时,需要排除功率变化对于实验结果的影响。一般而言试验中功率变化必须小于2%。
激光还必须是可以调谐的。试验中激光所需要的频率取决于光遗传学操作或者复现的生理过程频率;同时也受到视蛋白的动力学性质的影响。在大脑中的某些活动的频率是在秒量级上,而另一些则超过了100 Hz。
此外激光脉冲的上升/下降时间短、上升/下降时间在毫秒级、复现性好也很重要。脉冲形状,每个脉冲的顶峰功率一致和脉冲重复性也同样重要。
光遗传学使用的激光器主要是DPSS激光器和二极管激光器。这两种激光器都体积小巧,非常节能,且不需要任何冷却系统。激光二极管是最经济的选择,可以发出蓝光和红光,但是不能发出绿光,黄光或橙光。激光二极管调谐可以达到极大的精度和速度,只受到电路本身的限制。激光二极管可以在0到最大额定功率之间任意设置,同时保持稳定性。
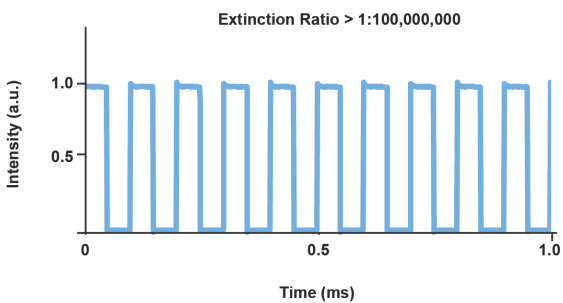
图4.典型的直接调制Cobolt MLD 473-nm激光器脉冲图形。
DPSS激光器是功能强大,性能高,可以用在许多要求苛刻的使用中。DPSS激光器在可见光区域中有很多波长可以选择,其中光遗传学研究中以532,561和594 nm的波长最为常用。如DPSS激光器这样的光学泵浦激光器都受到它们的结构限制,而二极管激光器的激光是由激光器腔内的激光晶体泵浦的。光学泵浦激光器仅在连续运转,并在最大额定功率运行时才能保持稳定,这些限制只有在经过精心设计的器件会有所不同。
然而我们可以将DPSS激光器被设计成具有很宽的动态??功率范围,同时还具有调谐能力。但是直接调谐的DPSS激光器通常不具有能满足光遗传学需求的脉冲一致性和功率稳定性。因此,用于光遗传学研究的DPSS激光器需要一个内置的调制器或较快的快门来调谐光,使设备连续工作,来尽可能达到设计允许达到的稳定性(图5)。

图5.具有内置调制器的Cobolt Mambo 594-nm激光器的激光脉冲图形。
实时位置偏爱光遗传学试验中还研究了涉及厌恶的神经元群体,即负责避免不愉快的神经元。科学家把蓝色光敏的ChR2视蛋白标记在小鼠大脑半球的研究区域内,然后把200μm大小的光纤加上光纤探针置于直接要操作的神经元上。实验场合是一个被分为两间,中间有门互通的矩形盒子。试验中用一个软件跟踪老鼠的移动,老鼠进入盒子其中的一间会触发激光器发出蓝色激光,激活视蛋白和研究的神经元。
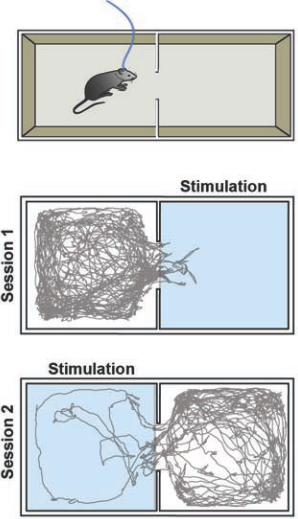
图6.这个模型演示了实时位置偏爱。实验分为两节各十分钟,两节中第一节是右腔室会激发激光,第二节是左腔室会激发激光。老鼠首先放在右腔室中,第二节开始时老鼠位于左腔室,灰线代表了老鼠的运动轨迹。试验中用的是带有Doric镜头分支跳线的Cobolt MLD 473-nm 激光器,最大输出功率为120 mW。使用Arduino微控制器来控制激光,并Biobserve软件跟踪老鼠的位置。激光频率为60赫兹,2毫秒脉冲长度。
图6演示了实验结果,可以看到光可以直接操作老鼠的厌恶行为,老鼠几乎不会去会激活激光的那间屋子。为了证明这种厌恶行为是由于被激光激发的神经元带来的后果,而不是由于外界因素引起的。我们把触发激光的条件进行了对换,可以看到,老鼠不会涉足的屋子也随之改变了。
参考文献:1. F.H. Crick (1979). Thinking about the brain. Sci Am, Vol. 241, pp. 219-232.
2. G. Nagel et al (2005). Light activation of channelrhodopsin-2 in excitable cells of Caenorhabditis elegans triggers rapid behavioral responses. Curr Biol, pp. 2279-2284.
3. F. Zhang et al (2007). Multimodal fast optical interrogation of neural circuitry. Nature, Vol. 446, pp. 633-639.
4. K.M. Tye and K. Deisseroth (2012). Optogenetic investigation of neural circuits underlying brain disease in animal models. Nat Rev Neurosci, Vol. 13, pp. 251-266.
5. O. Yizhar et al (2011). Optogenetics in neural systems. Neuron, Vol. 71, pp. 9-34.
6. F. Zhang et al (2007). Circuit-breakers: optical technologies for probing neural signals and systems. Nat Rev Neurosci, Vol. 8, pp. 577-581.
7. O. Yizhar et al (2011). Neocortical excitation/inhibition balance in information processing and social dysfunction. Nature, Vol. 477, pp. 171-178.
8. J.Y. Lin et al (2013). ReaChR: a red-shifted variant of channelrhodopsin enables deep transcranial optogenetic excitation. Nat Neurosci, Vol. 16, pp. 1499-1508.
9. A. Berndt et al (2014). Structure-guided transformation of channelrhodopsin into a light-activated chloride channel. Science, Vol. 344, pp. 420-424.
10. J. Mattis et al (2012). Principles for applying optogenetic tools derived from direct comparative analysis of microbial opsins. Nat Methods, Vol. 9, pp. 159-172.
11. N.C. Klapoetke et al (2014). Independent optical excitation of distinct neural populations. Nat Methods, Vol. 11, pp. 338-346.
12. A.S. Chuong et al (2014). Noninvasive optical inhibition with a red-shifted microbial rhodopsin. Nat Neurosci, Vol. 17, pp. 1123-1129.
这篇文章最早发表在2015年1月的《BioPhotonics》杂志上。
________________________________________
光遗传学简史光遗传学的概念可以追溯到20世纪70年代,当时DNA的发现者之一弗朗西斯·克里克博士指出神经科学研究中需要控制一组特定的神经细胞,同时使其他细胞不受影响,来了解如何大脑工作的。克里克博士后来还提出可以使用光来在外部控制神经元,可以实现大脑处理过程中高精度的时间尺度分辨。
与此同时,生物学家在当时发现了能够具有光敏蛋白(视蛋白)助剂的微生物,这些微生物同时还具有调节离子(电荷)通过细胞膜的能力。基于神经元活动是由离子通过细胞膜的流动来控制的事实,科学家在20世纪90年代末开始探索利用光敏蛋白控制神经元,但直到21世纪初研究人员才开始认识到视蛋白适用于神经科学的研究中。由几个研究小组对这项课题的协作研究项目在2005年的时候结出了果实,他们首次实现了通过单组份光敏感蛋白的离子通道来激活和改变活体生物的行为。科学家很快就确定了光活化蛋白质可以抑制神经元的活动,并在2007年首次使用抑制视蛋白来实现行为控制。
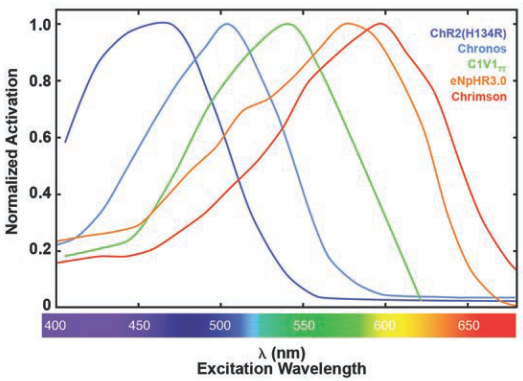
图7.归一化视蛋白的激活光谱。ChR2(H134R),Chronos,C1V1TT和Chrimson是激活视蛋白,channelrhodopsin-1或-2则与之相反。eNpHR3.0是halorhodopsin派生的氯泵。
自2005年发现和普及了光遗传技术之后,科研人员开始发现光遗传学的种种用途,普遍认为这项技术是大脑及其功能研究领域中最具革命性的手段之一。神经科学的终极课题是理解大脑是如何引发我们的行为,而在这项研究中光遗传学发挥了前所未有的效用。科学家将种种不同的激活和抑制视蛋白标记到啮齿类动物不同类型的神经元和脑区中,以确定在大脑中负责诸如害怕、焦虑、睡眠、饥饿、社会行为、学习、记忆、侵略、动机和更多功能的区域。此外,光遗传学也被广泛用来研究精神和神经疾病中大脑行为的改变,类似的疾病如抑郁症,精神分裂症,孤独症,帕金森氏病,癫痫和药物成瘾等等。光遗传学研究中不仅仅只能观测行为的改变,还可以与成像或者电生理学等等技术结合起来。
一般对于视蛋白的分类方法包括它们的效果(激活与抑制神经活动),光谱灵敏度(峰间隔波长),通过细胞膜的方式(通道或泵),激活或者抑制作用,光性能等等。大多数视蛋白的激活波长很宽(图7和8)。在峰值时视蛋白具有最大活性和光电流。当前用于光遗传学的光激活蛋白峰值激发峰值普遍在可见光或红外光区。最常用的活化视蛋白,Channelrhodopsin-2(ChR2),激发光波长在470nm附近(蓝色光),与最常用的抑制神经元活动(halorhodopsins,NpHRs)视蛋白激发光波长在黄光(590nm左右峰激活)附近。
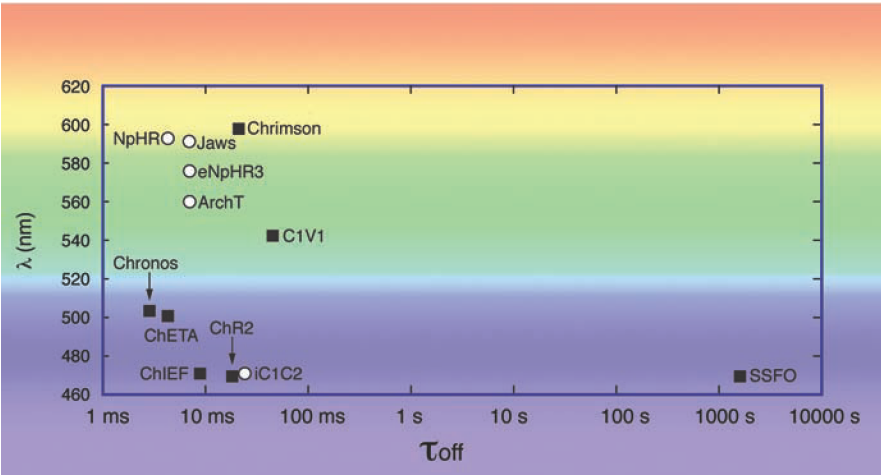
图8. 视蛋白的不同动力学(τ
off)和光谱参数(λ)选择。在光遗传学实验规划中,需要激活两个单独的神经元细胞群体或并发的激活和抑制神经元细胞群,对他们的激活波长进行比较。在指定光脉冲频率的试验中必须考虑视蛋白的衰变动力学。其中激活视蛋白为白色圆圈,抑制视蛋白为黑色正方形。
更重要的是,科学家在最近几年里为光遗传学设计和改造了很多种菌群视蛋白。现在试验中的视蛋白已经可以做到通过改变入射光的波长做到交换大脑中激活和抑制的区域,或者在相同的大脑区域内同时平行的激活不同的神经群。在这些案例中的关键是如何用不同波长的光选择性的激活某种特定的视蛋白而不影响其余。如果试验中两种视蛋白处于大脑的同一区域内,选择激发光波长和功率时就必须考虑光谱重叠和光电流的相对强度。
光遗传学的最新进展还包括可以用一个波长的光激发视蛋白,同时用另外一个波长的光使视蛋白失活,这种视蛋白也被称为阶跃视蛋白。利用这种视蛋白,我们可以用一个波长的单个光脉冲激活视蛋白,并控制离子流逐渐变化,然后被变化到另外一个波长的入射光脉冲湮灭。通常在试验中,科学家会用蓝光作为激发光脉冲,红光作为湮灭光脉冲,当然也有其他的组合。同时也有科学家在设计和寻找能用红光激活的视蛋白。
向活体动物的大脑植入光纤需要复杂和高精密的微装置,同时也会经常造成相当幅度的脑损伤。由于蓝光和绿光会在大脑内散射,同时会被血液吸收,光纤探针需要放置在非常靠近研究的区域来有效的激活视蛋白,这使得光遗传很难研究小目标或者大脑深处的结构。而红光能够更好的透过脑组织,同时吸收和散射也更少,甚至能透过头骨。最近一个重要的发现是生成了对蓝光敏感的抑制光敏感通道。这项发现将使光遗传学研究中对于神经元活动的光学抑制实现的更快、更多,同时提高了光敏感性。
(翻译: 北京鼎信优威光子科技有限公司 汪 阳 博士)







