摘要:我们在这篇应用中介绍了基于Nanonics AFM/NSOM系统的NSOM FLIM,此外系统中的器件还包括BH公司的Simple-Tau 150 TCSPC FLIM系统。这套系统可以采集高像素点以及每个像素点都是全荧光衰减函数的FLIM数据。我们成功的利用这套系统来记录半导体表面的纳米群岛的FLIM数据。
原理
近场扫描光学显微镜 (简称为SNOM或NSOM)把原子力显微镜 (AFM) 和激光扫描显微镜的原理结合了起来。原子力显微镜通过一个很小的尖端保持与样品一个分子的距离遍历样品的表面。我们在实际操作中可以把激光通过用光纤制成的尖端引向样品,如图1左所示。或者通过聚焦来自显微镜的激光照亮金属尖,在尖端的瞬态场可以用于探测样品结构(如图1右所示)。在这两种结构中荧光光子都是由显微镜的物镜收集的,通过压电驱动平台移动样品(而不是尖端)来实现对于样品的扫描。
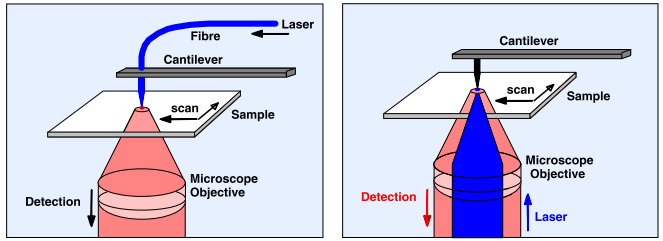
图1: 光学近场显微镜: 左: 锥形光纤。右图: 针尖增强显示。
NSOM原理结合了来自于AFM 纳米尺度的形貌信息和来自于光学探测的光谱信息。
由于NSOM使用了可以和TCSPC FLIM简单结合的扫描原理,在2003年和2004年就已经实现了数据整合。FLIM如果想和NSOM联用,我们对于系统的需求是要有一个来自于压电控制器的同步脉冲输出(帧开始,线开始,像素开始),同时输入光为脉冲激光,以及存在一个单光子检测器检测荧光。
Nanonics AFM/NSOM系统
在试验中我们使用了Nanonics Imaging Ltd.的AFM/NSOM系统,整个系统如图2左所示,带有AFM尖端的扫描平台如图2右所示。

图2,左,Nanonics系统的照片;右,带有AFM尖端的扫描平台。
如图2左所示,我们进行FLIM实验的系统是双显微镜系统,对于样品的激发和扫描都可以从样品的上下两个方向进行,同时也都具有尖端增强和光纤两种模式。
为了得到AFM和NSOM图像,我们把样品安置在一个三维的压电平台上,这个压电平台既可以让AFM探针保持在距离样品恒定的距离上,也可以得到扫描时候的坐标。我们在下面展示的图像都是来自于光纤模式。
FLIM系统
我们将Nanonics系统与bh BDL SMN 488 nm皮秒二极管激光器,bh Simple-Tau 150 TCSPC FLIM系统和 bh HPM-100-40 GaAsP混合探测器集成到了一起,整个系统如图3所示。

图3,FLIM系统的组分,从左到右:bh BDL SMN 488 nm皮秒二极管激光器,bh Simple-Tau 150 TCSPC FLIM系统和bh HPM-100-40 GaAsP混合探测器。
BDL SMN二极管激光器会产生50ps脉冲长度的488nm波长激光,重复率可以是80,50或者20MHz。激光具有束流剖面校正和 Qioptiq 型单模光纤连接器。输入到光纤的功率是2mW,重复频率是80MHz。如果加大脉冲时间的话还可以得到更高的功率。
Simple-Tau 150系统含有一个包含总线扩展电缆和扩展盒的笔记本。扩展盒里有bh SPC-150 TCSPC/FLIM模块和DCC-100探测器控制器。HPM-100探测器包括一个滨松R10467-40混合型PMT管和一个GHz的带宽低噪声前置放大器。探测器的探测效率为50%,而且可以在脉冲之后探测。对于FLIM装置这是很好的光子效率:达到指定所需要的光子数很接近理想值。
SPC-150 TCSPC卡的荧光寿命成像是基于一个多通道的TCSPC过程,整个原理如图4左所示。TCSPC模块接收来自于探测器的单光子脉冲,来自激光的时间参考脉冲,以及来自于Nanonics系统压电控制器的同步脉冲输出(帧开始,线开始,像素开始)。对于每一个光子,TCSPC系统都会确定它在激光脉冲周期内的时间,t,以及扫描区域内的位置(x,y或者AFM探针)。通过这些信息,TCPSC系统可以建立具有x,y和t的光子分布。这样的分布包含通过包含一个激光脉冲周期内的完整荧光衰减曲线(t)的像素集合(x,y)。这个程序的优势在于它在每个像素点记录了一个完整的荧光衰减曲线,而不仅仅是一个荧光寿命。此外,它还具有接近完美的光子效率,可以使用的扫描速率很多。在激光扫描显微镜内(扫描速率为10
6像素点每秒),采集得到的数据量很大。而在慢速扫描过程中每秒的数据可能只有一帧。按照推论,如果积分时间和探测的速率是一致的,扫描速率和结果也是独立的。
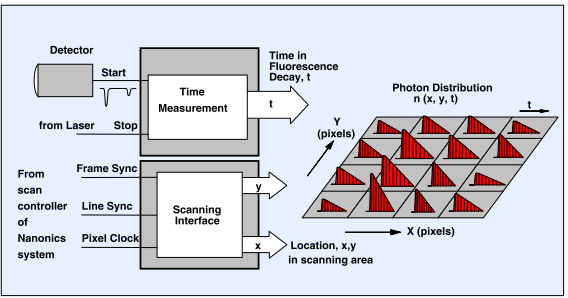
图4,TCSPC FLIM的原理。
和64位SPCM 数据采集软件联用的SPC-150模块可以记录的图像像素大小达到了百万级。这样FLIM系统所记录的像素量级就和AFM中常用的像素量级相当。同时使用256, 1024和4096个时间通道能够达到的分辨率为2048 x 2048,1024 x 1024和512 x 512。当NSOM的衰减数据包含快速和慢速这样衰减速率差异很大的组分时,多时间通道的优势就体现出来了。
所有的数据都是按照上文描叙的原理记录的,在SPCM数据采集软件的FIFO Imaging模式里面采集,使用的数据分析软件是SPCImage。
结果
图5是半导体表面上的纳米群岛荧光材料,从左到右是AFM数据、FLIM数据和结合荧光寿命的AFM数据。

图5,半导体表面上的纳米群岛的NSOM FLIM图像,从左到右是AFM数据、FLIM数据和结合荧光寿命的AFM数据。使用的拟合参数是幅度权重的双指数曲线。使用的系统是bh BDL SMN 488 nm 皮秒二极管激光器,带有bh Simple-Tau 150 TCSPC FLIM系统的Nanonics AFM/NSOM显微镜。
总结
如果NSOM系统可以提供一个来自于压电平台的同步脉冲信号,一个来自于脉冲激光的光学输出,以及来自于光子计数探测器的光学输出,那么它可以很简单的与FLIM系统联用。而这些需求都可以被Nanonics的AFM/NSOM系统满足。我们用一个bh的Simple-Tau 150 TCSPC FLIM系统,一个bh BDL-SMN皮秒二极管激光器,一个bh PMH-100-40混合型探测器。NSOM FLIM系统的优势在于可以同时得到高分辨率的形貌数据和荧光寿命数据。这样的数据可以把形貌以亮度和荧光寿命以颜色的方式来一起展示。这项技术经过改进之后还可以与荧光/磷光寿命成像、多波长激光复用、多波长探测以及NIR探测。
References
1. W. Becker, Advanced time-correlated single-photon counting techniques, Springer (2005)
2. W. Becker, The bh TCSPC handbook. Becker & Hickl GmbH, 6th Edition (2015), www.becker-hickl.com, printed copies available from bh
3. Becker & Hickl GmbH, BDL-SMN series picosecond diode lasers. User handbook, www.becker-hickl.com
4. Becker, W., Su, B., Weisshart, K. & Holub, O. (2011) FLIM and FCS Detection in Laser-Scanning Microscopes: Increased Efficiency by GaAsP Hybrid Detectors. Micr. Res. Tech. 74, 804-811
5. Becker, W., Su, B., Bergmann, A., Weisshart, K. & Holub, O. (2011) Simultaneous Fluorescence and Phosphorescence Lifetime Imaging. Proc. SPIE 7903, 790320
6. Becker, W., Su, B., Bergmann, A., Weisshart, K. & Holub, O. (2011) Simultaneous Fluorescence and Phosphorescence Lifetime Imaging. Proc. SPIE 7903, 790320
7. Becker & Hickl GmbH, MWFLIM GaAsP multi-spectral FLIM detectors. Data sheet, www.becker-hickl.com
8. W. Becker, V. Shcheslavskiy, Fluorescence Lifetime Imaging with Near-Infrared Dyes. Proc. SPIE 8588 (2013)
9. R.C. Dunn, Near-field scanning optical microscopy, Chem. Rev. 99, 2891-2927 (1999)
10. D. Hu, M. Micic, N. Klymyshyn, Y.D. Suh, H.P. Lu, Correlated topographic and spectroscopic imaging beyond diffraction limit by atomic force microscopy metallic tip-enhanced near-field fluorescence lifetime microscopy, Rev. Sci. Instrum. 74, 3347-3355 (2003)
11. M. Micic, D. Hu, Y.D. Suh, G. Newton, M. Romine, H.P. Lu, Correlated atomic force microscopy and fluorescence lifetime imaging of live bacterial cells, Colloids and Surfaces B, Biointerfaces 34, 205-212 (2004)
12. Studier, H., Becker, W. Megapixel FLIM. Proc. SPIE 8948, (2014)
13. www.nanonics.co.il
(翻译:北京鼎信优威光子科技有限公司 汪 阳 博士)




