荧光寿命成像-技术与应用
作者:Wolfgang Becker (翻译:北京鼎信优威光子科技有限公司 汪 阳 博士)摘要
荧光寿命成像(FLIM)利用了荧光团的荧光寿命取决于其分子环境而不是浓度的原理。因此可以在无需了解荧光团浓度的前提下独立的调查分子对于荧光寿命的影响。利用显微镜观测荧光寿命技术存在很多变种。这篇文献的技术部分主要介绍了多维时域FLIM时间相关单光子计数、通过门控图像增强的时域FLIM、通过增益调制图像的频域FLIM和使用光电倍增管的频域FLIM。应用部分介绍了最常见的一些FLIM应用:测量分子环境参数、荧光共振能量转移(FRET)观测蛋白质相互作用和通过细胞自发荧光组织观测细胞或者组织的代谢状态。我们可以通过荧光团的淬灭或者荧光寿命的变化来计算环境参数或者构象变化。这种基于强度的测量不需要特定比例的荧光团,因此可以选择更多种类的荧光团,同时可以测量更多的细胞参数。FLIM-FRET技术测量了供体与受体反应之后的荧光寿命衰减变化。结合FLIM的FRET测量无需考虑供体渗漏或者入射光直接激发受体这样的问题。这同样也放宽了对于供体与受体的光谱选择。此外,FLIM-FRET测量能够分辨活性与非活性供体的分数,这样就能分别观测供体与受体之间的距离和参与反应的蛋白质分数。这是稳态的FRET技术无法做到的。自发荧光FLIM用内源性荧光团探索了细胞或组织的代谢状态带来的衰减参数改变。在了解生物相关化合物结合、构象,和组成等方面,FLIM可提供稳态荧光技术无法得到的信息。
简介
由于荧光技术极为敏感并且能在分子尺度上提供生物化学信息,从而被人们广泛应用于显微镜活体研究中。除了需要在样品上标记荧光团之外,荧光技术基本无创、无损,可以直接应用于活体样本上。而多维显微技术的引入也加速了荧光技术的发展。在试验中可以获得不同维度的实验数据,比如波长、试验时间或者光的偏振方向。而且荧光特征不仅仅包括荧光强度的空间分布和荧光光谱,还包括荧光衰减函数:当分子吸收光子进入激发态,它可以以不同的方式返回基态,包括发射光子、转化成热量或者杂交到三重态。对于同源性分子得到的荧光衰减曲线是单指数函数。这个函数的时间常数,荧光寿命,是所有可能的返回路径速率的倒数之和。速率常数,即荧光寿命,取决于分子类型、环境、构象以及与周围分子的相互作用。
在所有可以测得的荧光参数中,荧光寿命是可以最直接的表达荧光团标记分子与周围环境相互作用的参数。由短脉冲激光激发荧光可以得到荧光衰减函数,激光脉冲后的荧光寿命测量精度可以达到纳秒量级,乃至皮秒量级。
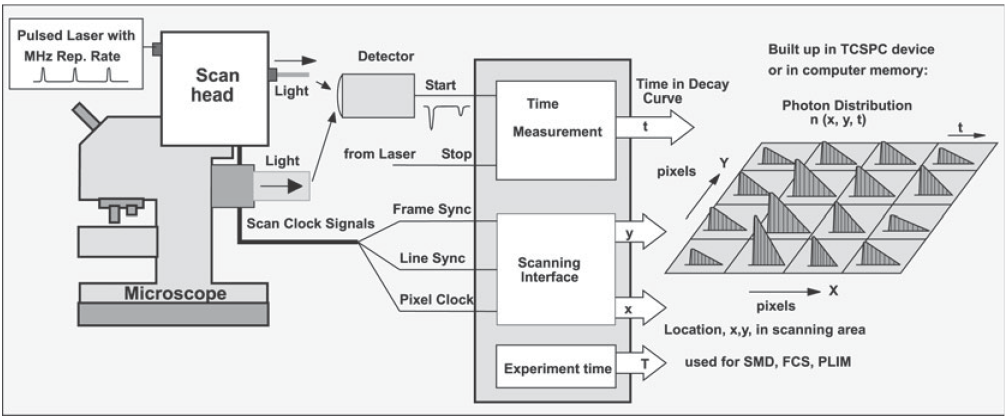
图1,TCSPC FLIM原理
FLIM技术
荧光寿命成像(FLIM)可以通过时域、频域、光子计数、模拟技术、点扫描和宽场成像等等技术来实现。不同技术之间的区别取决于获取数据时使用的时间通道多少,采集数据时是同时采集还是按顺序采集。科研工作者们穷尽了几乎所有的组合,这导致了市场上的仪器原理各异。不同原理仪器的差别主要体现在:光子效率,即得到给定的寿命精度所需的光子数;记录这些光子所需的累计时间;时间分辨率内的光子通量;多指数荧光寿命衰减曲线的分析;多波长能力;光学切片能力和与不同成像与显微镜技术兼容性的参数。
时域TCSPC-FLIM技术
时间相关单光子计数(TCSPC)FLIM使用了多维时间相关单光子计数程序,这是对经典TCSPC技术的一个扩展。图1是这项技术的原理示意图。试验中用高频的脉冲聚焦激光扫描样品。对于数据的记录基于对单光子荧光的检测,以及利用激光脉冲和探测时的位置来确定光子到达时间。根据这些参数,我们可以描述光子的空间坐标,(x,y),和脉冲激发光子所需要的时间,t。这样我们可以得到一组三维的数据,包含二维扫描的像素点以及大量时间通道内得到的荧光寿命。
在本文所描述的多维TCSPC FLIM技术可以达到目前最高的时间分辨率。在来自样品的光子数目稳定的情况下,它同时还具有最高的寿命准确性和光子效率。TCSPC FLIM系统具有许多生物系统寿命成像所需要的重要特征:能够拟合复杂的衰变曲线;能够克服在采集过程中荧光衰减参数的动态变化。此外,TCSPC FLIM技术还可以完美的兼容共焦或者多光子扫描显微镜。这些系统中的快速扫描速率也不会影响TCSPC FLIM的结果:记录程序只需要采集到让信噪比足够大的图像就可以了。此外,TCSPC FLIM技术还利用了共聚焦和多光子扫描能达到光切片的优势:采集到的数据来自于样品的特定平面,不会受到来自于焦平面之外的荧光的污染。
光子分布可以得到很多参数,比如光子的波长,或者几个多路激发激光器的波长,又或者样品非周期性刺激的时间。可以通过分光荧光光谱和突出多阳极光电倍增管里元素的光谱来得到光子的波长。FLIM系统决定了探测了特定光子的PMT通道(或者波长通道)数目。数据记录过程可以得到光子的空间坐标,x,y,光子时间,t,和波长通道,λ。数据记录了在不同波长下特定坐标的的衰减曲线。Biskup和Rück报道了TCSPC在光动力治疗染料和FRET研究领域中的应用。
试验中可以用一个类似的过程得到不同波长下的荧光寿命图像。不同的激发波长可以在帧与帧、行与行切换,甚至在一个像素点内共存。此时激光波长通道可以用来作为光子分布的坐标。
快速动态过程可以通过在激发样品的激光脉冲之后附加一个时间坐标来记录。科研工作者开发了一种名为“荧光寿命瞬时扫描”的技术用线扫描来记录小至1 ms时间分辨率的荧光寿命改变。
为了得到FLIM数据,TCSPC系统必须记录单个可探测光子的完整信息。在研究中这类“光子参数数据”可以用在许多方面,比如单分子探测,荧光相关光谱和磷光寿命成像。
科研工作者普遍认为TCSPC FLIM系统一个劣势在于较长的积分时间。正如Becker和Katsoulidou指出的,这个劣势更像是一个普遍的误解而不是真实存在的劣势。实际上,TCSPC FLIM系统对于图像的记录不会比扫描仪对于样品的扫描更慢。当然TCSPC系统的计数速率存在着天然的限制。但是对于典型TCSPC FLIM系统的应用而言,计数速率的限制更多的来自于样品的成像稳定性而不是FLIM系统的计数速率。鉴于其接近理想的光子效率,可以说TCSPC FLIM系统能在所有基于样品扫描的FLIM系统上所需要的积分时间最短。
门控影像增强的时域FLIM
图像增强器包含有光电阴极真空管,可以增益光电子的二维图像检测系统。图2表示了如何用多通道平板来增益电子。一个典型的微通道板的增益是1000倍左右,2个联用的平板可以达到10
6倍之多。
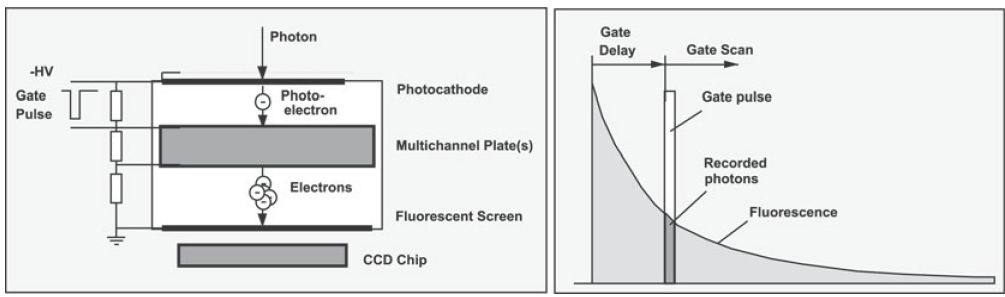
图2,门控图像增强器。
试验中我们可以通过门控影像增强器得到时间分辨率。这是通过在多通道平板和光电阴极或耦合到导电格电容之上的光电阴极之间的门控脉冲来实现的。可以通过扫描门控时间内的荧光衰减函数,即图2右中的通过采取不同延迟选通脉冲的连续图像。
门控影像增强器一般会和宽场激发或者多光子多光束扫描联用。宽场图像的优势在于可以得到所有像素点的信息。虽然在实际实验中用时间信息顺次所用的采集时间可以做得比用于基于空间扫描技术短。
门控记录的缺点是仅仅能记录一部分光子,导致光子效率较低,而整体的样品曝光较高。而且宽场激发会引入激发平面之外的荧光。只有样品非常薄的情况下才不会受到焦平面之外荧光的污染。来自焦平面之外荧光的污染不仅仅会带来图像对比对的失真,也会给荧光衰减函数带来不必要的组分。
我们可以通过仅仅记录一小部分时间门控数据解决效率问题。这些时间门控的图像可以通过不同延迟的光阴极来按顺序或者同时采集数据。但是这会带来衰减函数的采样不足,所以很难通过荧光寿命和振幅来得到多指数荧光寿命衰减曲线的拟合。

图3,频域FLIM原理,荧光寿命可以通过减少荧光相比于激发光的调制角度和相移来得到。
从理论上说,我们可以用结构照明技术去除焦平面之外的信号。但是这类技术都是基于对不同照明参数得到的图像结果差异进行的计算优化。虽然我们得到的图像只包含来自于焦平面的信号,但是图像中还含有来自于所有荧光检测平面的散粒噪声。
基于门控影像增强器的系统可以用来得到多光谱的FLIM。试验中我们用相同的门控影像增强器管,用一个相同的门控扫描得到不同波长下的间隔图像。此外还可以激发样品上的一条线,或者把这条线上的荧光投影在光谱仪的入口狭缝内。这样在试验中我们可以通过移动样品或者激发垂直于这条线的延伸来扫描样品的不同部分。通过门控图像增强器记录光谱仪的输出的光谱。这样激发线和光谱仪的狭缝会形成一个共焦系统,可以抑制焦平面之外的信号。
频域FLIM技术
我们可以通过傅里叶变换来实现时域和频域技术的转化。时域技术得到的数据会在不同的时间通道内标识强度值。而在频域技术中类似的技术可以表示为信号重复频率内的幅度与相位值。但是这不意味着时域和频域这两种技术的记录原则和仪器完全一致:时域技术中,我们会记录大量时间通道内的全波形数据。但是在频域技术中,我们无法同时记录所有重复波形与其谐波的幅度与振幅。所以,大部分频域FLIM技术都只记录基波的频率和相位值。这样得到的数据可以用来表征样品的荧光衰减相位,具体可见“数据分析”章节。
图3是频域技术的大体原理。我们使用调制或者脉冲光激发样品。由此得到样品荧光相比于激发光有角度和相位的差异,由此可以用来确定荧光衰减曲线。
科研工作者一般会使用增益调制的相机或者宽场激发,又或者使用增益调制点探测器扫描和探测荧光来得到频域FLIM数据。图4是这项技术的原理。探测器或者相机的增益由震荡频率,
fOSC,调制,这个频率的含义与激光频率或者调制频率,
flaser,有少许的差异。然后,我们可以把荧光信号的相位和幅度转化为不同的差频,
flaser- fOSC。这项操作和电台使用的外差技术相同。实际上有科学家报道了使用低成本通讯组件来搭建频域FLIM系统。外差原理的优点在于差频独立和差频频率较激光频率要低很多。我们可以通过数字技术来进行滤波和信号处理得到了不同的频率,这些频率决定了相位和幅度。
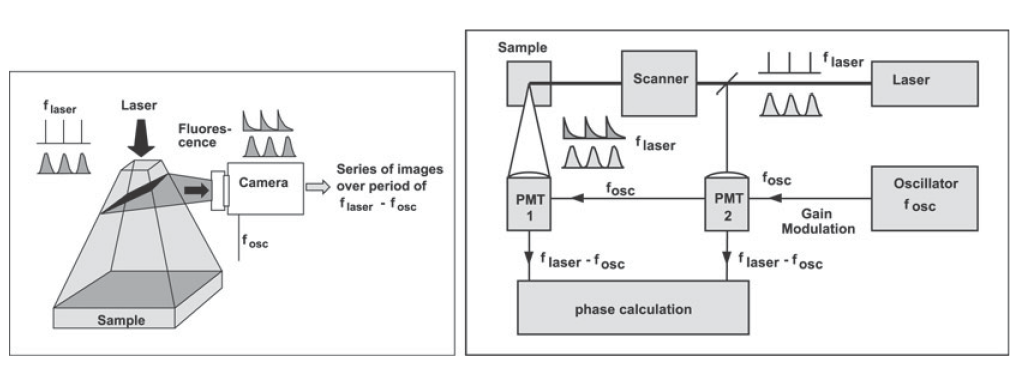
图4,频域FLIM技术,左,调制相机,右,扫描和调制的点探测器。
对于激发光和探测的调制并不需要一定是正弦波。因此频域系统可以使用高频的脉冲激光。
在频域FLIM技术中,我们把荧光信号视为一个模拟的波形,而不是一个独立的光子探测事件。因此带来的后果就是实验计数非常大,很难探测单光子事件。问题可能在于平均而言,探测器对于时间间隔内相位计算时如果只接受了一个光子,那么得到读数非常低。
仪器的一些细节也决定了频域FLIM技术的光子效率。激发光源和探测器的调制角度的加大会增加光子效率。一般而言,理想的调制意味着对于激发光强度和探测器的增益都在-100%和+100%之间波动。对于正弦激发而言由于参数极性不能翻转,这个要求无法达到。只有使用短脉冲激光和方波信号调制探测器的情况下才能得到最好的光子效率。此外探测器的增益调制或者光子探测效率的调制也会影响到光子效率。效率调制会抑制一部分的光子信号,导致信噪比劣化。
Gratton等人在2003年通过实验对比了TCSPC FLIM系统和调制点探测器的频域FLIM 系统。他们报道中提及对于低浓度和低计数样品而言,TCSPC FLIM系统能够给出更好信噪比的荧光寿命结果。而在高浓度高计数的样品环境下,这两种技术信噪比相当。
其余的FLIM技术
实际科研中还存在着种种其他的FLIM技术,它们之中的一些会和显微镜联用。我们将在这儿简单的介绍一下这些技术。
时间门控光子计数和激光扫描联用来记录荧光寿命图像的技术可以得到很高的光子效率和相当大的计数。这项技术里面使用的计数器是有数个平行门控计数装置的高速探测器。从原理上说,门控计数可以处理极高的计数,甚至可以超过探测器的过载极限。代价是时间门控数目非常有限,因此很难得到时域数据,而对这样的数据进行多指数衰减曲线拟合从而得到荧光寿命的振幅和参数也是一件非常困难的事。
条纹相机和激光扫描显微镜联用也可以用来记录FLIM数据。条纹相机可以同时记录试验数据的x和t。我们可以用条纹相机来记录多光谱FLIM数据或者在数据读出之前记录对一条直线的扫描。此类系统的表现依赖于条纹相机的参数,特别是读出速率和相机能处理的激发脉冲速率。
TCSPC系统还可以和位敏探测器联用,这样我们就可以得到一个具有单光子敏感性和绝佳时间分辨率的宽场FLIM技术。缺点是无法得到与深度相关的信息。
(扫描)TCSPC FLIM技术还可以和多光束扫描联用。我们把来自于几个不同的激发点的光信号引入到多阴极光电倍增管的阳极,使用一个单独的TCSPC模块来对荧光衰减、扫描坐标、多阴极光电倍增管的探测通道的光子进行时间分辨。这个系统的原理与平行TCSPC通道的原理类似。已经有科学家使用八平行通道的TCSPC系统来成功的构建多光谱FLIM系统。
如果只需要不是太高时间分辨率的宽场FLIM,可以使用门控或者调制的电荷耦合器件 (CCD) 图像传感器。这样构建系统技术简单,费用低,但是无法分析亚纳秒或者皮秒分辨率的FLIM数据。
在TCSPC技术发展的早期阶段,人们试图构建基于单光子雪崩二极管阵列的图像传感器,具体实验中必须冷却这些阵列来让单光子雪崩二极管工作。通过积分每个像素点或者像素行上传感器芯片的时数转化器,可以得到光子的时间。这个技术的缺点是暗计数过高,而且需要很高的读出速率:对于一个一共有100000个像素点的阵列而言,它的暗计数为10
6光子/秒。信号的计数应该比这高出10到100倍才能得到较好的结果。试验中记录每个光子的位置和时间数据需要24比特的数据。所以对于这个阵列而言,数据的读出速率需要达到240 Mb/s到2.4Gb/s。如此高的数据传输要求很难达到,但是依然存在满足要求的可能。可是如此高速的时间和数据传输电流会产生热量。这让对于阵列的低温冷却很难保持,这又反过来加剧了暗计数。
Petrasek和Suhling报道了带有快速读出相机的影像增强器的荧光寿命成像装置。利用具有出色光学分辨率的相机系统来探测单光子和得到它的x-y位置。由于没有使用门控技术,这个系统具有极高的光子效率。在初次接触这个系统的时候,读者可能会认为这个系统的时间分辨率极限是相机的最大帧速率(250kHz)。但是,Petrasek和Suhling发现可以使用在图像增强器上荧光团的发光衰减时间输出来得到帧图像内的光子抵达时间。最后可以得到的时间分辨率是40 ns。
数据分析

图5,时域FLIM系统的数据分析。
时域数据
来自于TCSPC FLIM系统或者门控摄像系统的时域FLIM数据包含了一系列(通常数量巨大)时间通道内的阵列像素点数据。时间通道包含了激发之后连续光子数目,如图5中所示。我们会使用一个迭代卷积过程来计算得到数据中的荧光衰减曲线参数。我们计算得到的合适的荧光衰减曲线模型一般会由有些晦涩的概念:仪器响应函数(IRF)表达。IRF表示探测系统对于激发脉冲的响应。仪器响应函数的计算或者测量也是从荧光衰减数据得到的。在近几十年的试验中,这项技术被用于单指数荧光衰减曲线。对于FLIM而言,拟合过程必须针对图像的所有像素重复进行。
最简单的荧光衰减模型是单指数函数,即函数中只有一个单指数的衰减时间函数。但是对于大多数的情形而言,衰减曲线函数的拟合需要两个或者更多的指数。这样的模型里面包含了几个不同的衰减时间和幅度因子。最终呈现在FLIM上的图像包含了用亮度表示接收到光子数目,用颜色代表选择得到衰减参数(如图5右所示)。参数可以是单指数衰减函数的荧光寿命,或者是幅度/强度权重平均的多指数衰减曲线的荧光寿命,又或是简单的荧光寿命或者幅度比。
我们可以对分析算法进行若干改进,这些改进有助于高效的从噪声衰减曲线里面提取样品的衰减曲线。这样的算法包括最大似然分析或贝叶斯分析。即使是在低技术指标的单指数荧光寿命中光子分辨技术依然可以在第一时间(即光子到达探测器的平均时间)识别光子。第一时间的衰减数据与IRF得到的荧光寿命有所不同。第一时刻的计算亟需弱背景和完整记录一整段衰减曲线的情况下来计算。在满足这样的情形下计算第一时刻可以得到理想的信噪比。但是缺陷在于这对多指数衰减函数的拟合无能为力。
Weidkamp-Peters等人在时域技术的基础上发展了多指数分析。这项技术可以在一个探测通道内建立不同像素几个衰减参数的二维直方图,或者是不同探测通道得到的衰减指数和强度比例。在这些直方图里可以搜寻或者标记荧光团或者荧光团部分的特征,图像中对应的点也可以备注。
频域数据分析
每个像素点内的频域数据都包含两个信息:相位和调制角度。Digman开发的指针分析法可以优雅的分析这些数据。指针分析法并不是直接确定每个像素点的荧光寿命或者衰减指数,而是通过相位和调制角度来直接得到这些信息。对于每个像素点而言,我们可以在一个极坐标系里面定义一个指针(Phasor)。相位就作为这个指针的角度,调制角度就是这个指针的幅度。这样得到的点有几个显著的优势:
- 对于单指数衰减曲线而言,每个像素的向量值集合是一个半圆。向量的角度就是像素在半圆之上所处的位置,这个值取决于荧光寿命。
- 对于多指数衰减曲线而言,集合了数种衰减曲线的组分会落在半圆之内。
- 不同过程卷积的衰减曲线向量会落在半圆之外。例如FRET激发受体的发射,这就是供体与受体荧光衰减曲线的相互作用带来的卷积。
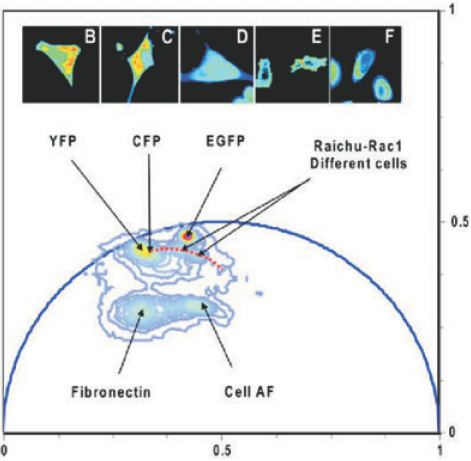
图6,Phasor分析。我们有五种不同的细胞,分别用YFP(B)、paxillin-CFP(C)、EGFP(D)和RAICHU-Rac1(E)转染,(F)是未转染的细胞,只有自发荧光。
具有不同特征向量点的像素会被在成像结果内用不同的颜色备注出来。图6就是其中的一个例子。在图6的上方从左到右,B-F,显示了不同细胞的相位点。细胞分别由黄色荧光蛋白(B),桩蛋白-青色荧光蛋白(C),增强型绿色荧光蛋白(D)和RAICHU-Rac1(E)转染。(F)是未转染的细胞。从图下部可以看出来自于不同向量点的荧光团落在了不同点上,也包括了未转染的细胞。值得注意的是所有的点都落在半圆之内,这表明在细胞环境下没有荧光团分子能表现出完美的单指数衰减曲线。
向量分析不仅仅限于在频域系统内得到的数据,还可以用来处理通过傅里叶转化的时域数据。
FLIM应用
为什么使用荧光寿命?
显微镜学家经常把荧光寿命当作一个附加的参数用来分辨不同的荧光团。不同的荧光团具有不同的荧光寿命,可以通过FLIM来分辨它们的信号。当然利用光谱分辨显微镜技术可以更容易和更好分辨不同的荧光团。
因此典型的FLIM应用都没有关注不同荧光团的分辨。而是用来分辨在不同环境下相同荧光团表现出的不同函数。这是利用了荧光团一个基本的性质,即在合理的范围之内,荧光团的荧光寿命取决于其分子环境而不是浓度。因此荧光寿命可以用来独立的研究不同而且通常未知荧光团浓度下的分子效应。
在FLIM应用中通常用到的效应有:
- 不同离子,特别是对于神经系统功能非常重要的钙离子和氯离子,的荧光淬灭或者磷光淬灭。
- 氧的荧光淬灭或者磷光淬灭。对于大多数荧光团,特别是荧光寿命比较长的荧光团而言,氧气是非常有效的淬灭剂。一个重要的实验就是观测氧气对于钌,铕,铂和钯的复杂氧化物磷光的强淬灭作用。
- 内源性荧光团,烟酰胺腺嘌呤二核苷酸(NADH)和黄素腺嘌呤核苷酸(FAD),存在着很强的氧效应。科学家在二十世纪三十年代就已经发现了类似的效应。Chance等人定义了氧化还原比作为氧在细胞的线粒体中使用量的直接指标。氧效应也可能存在于其他的内源性荧光团。
- 荧光团与生物目标的结合会改变荧光寿命。最有可能的机理是结合会改变荧光团的结构,继而改变内部无辐射衰减率。对于绝大多数应用于细胞生物学的染料而言,它们的荧光寿命或多或少的取决于它们结合的是蛋白质、RNA或者DNA,对于与蛋白质结合的那些染料而言,它们的荧光寿命同样也取决于蛋白质的结构。比如烟酰胺腺嘌呤二核苷酸(NADH)和黄素腺嘌呤核苷酸(FAD)就会因为与蛋白质结合而改变它们的荧光寿命。研究同样发现,细胞和组织的代谢结构同样会非常显著的影响荧光团的荧光寿命和强度。
- pH值:许多荧光团既含有质子化形式,也含有去质子化形式。这两者的平衡取决于溶液的酸碱性。如果质子化形式和去质子化形式的荧光寿命不同,这种荧光团就可以用来指示溶液或者细胞环境的pH值。
- 荧光能量转移:荧光能量转移,或者又被称之为FRET,指的是能量从第一个分子,供体,转移到第二个分子,受体,的反应。人们一般通过FRET来研究蛋白质的构象和反应。对于FRET的观测是FLIM最常见的应用之一。
- 聚集:染料分子的辐射和非辐射衰变速率取决于染料分子可能出现的聚集。聚集会受到染料分子微环境的影响;相关联染料分子荧光寿命的变化可以当作探针。聚集也用来观察染料在细胞中的内化。
- 粘度:我们可以通过“分子转子”来检测粘度。分子转子指的是具有高度内灵活性的荧光团。荧光团的旋转可以表现为辐射衰变路径。而溶剂的粘度变化表现为非辐射衰减率的变化。Kuimove和Levitt首先报道了用分子转子和FLIM技术检测粘度的方法。
- 接近金属表面:可以想象,当荧光团接近金属表面,特别是金属纳米颗粒的表面时,会对荧光团的衰减曲线有很强的影响。与之类似的,最近的研究也报道了荧光团接近非金属的纳米颗粒会导致稍微弱一些的效应。
- 纳米颗粒:通过纳米颗粒较长的衰减时间或者二次谐波发射,FLIM可以用来鉴别和定位生物组织内的纳米颗粒。这项技术可用来研究药物载体纳米颗粒或者纳米颗粒在皮肤上的扩散。
测量pH值和离子浓度
图7左侧是一个典型基于FLIM系统的pH测量装置得到结果。实验所用的样品是沾有BCECF的皮肤样品。BCECF既有质子化形式,也含有去质子化形式。这两种形式的荧光寿命不同,它们之间的平衡取决于pH值,表现出来的就是荧光寿命的不同。
图7右侧是对于老鼠脊神经节内不同的氯离子浓度测量。荧光探针是6-甲氧基-喹啉乙酰乙酯(MQAE)。MQAE会被氯离子淬灭,因此短荧光寿命代表了较高的氯离子浓度。Kaneko详细报道了这个实验。他们用双光子激发TCSPC FLIM系统,得到了在树突神经上深度差异为150微米的浓度差异。Gilbert研究了神经细胞里氯离子稳态的浓度改变,Funk等人研究了炎症下的氯离子浓度改变。
通过较为明显的寿命改变,在合理范围内的pH值或者氯离子浓度改变都可以使用FLIM系统很简单的测量得到。而且在生物环境或者溶液环境下的荧光染料的荧光寿命可能会发生改变。因此我们需要对于在生物环境下的荧光寿命进行校准,但是这很难得到。
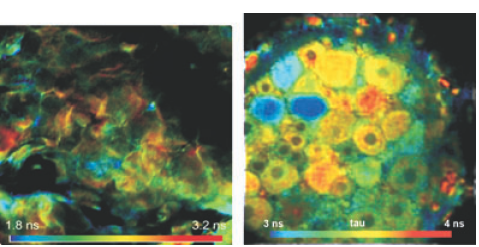
图7,左:沾有BCECF的皮肤组织的荧光寿命成像。荧光寿命是pH值得指示剂。右:沾有MQAE的老鼠脊神经节,荧光寿命与氯离子浓度成反比。
FRET
FRET是两种发射带和吸收带重合的荧光团分子之间的相互反应。在这个反应中,来自于第一个染料分子-供体-能量瞬时转移到了第二个染料分子-受体-里。这两个分子的能量偶极转移,不涉及任何光的激发和吸收。图8左侧表示了FRET的原理,从供体到受体的能量转移的效率和距离的六次方成反比。对于有机分子染料而言,FRET小于只在分子距离小于10nm的情况下才非常显著。FRET会导致供体荧光的淬灭,从而减少供体的荧光寿命,如图8右所示。
由于其在分子尺度上与距离相关,FRET成为了细胞生物学上重要的工具。供体和受体荧光染料可以转染在不同的蛋白质上,FRET可以用来鉴别这些蛋白质是否是物理相连的,从而确定纳米尺度上的距离。

图8,荧光共振能量转移,左图是原理,右图是供体的衰减曲线。
稳态FRET测量
基于荧光强度的FRET测量可以通过观测供体和受体的荧光强度来计算它们的浓度。由供体和受体荧光的强度比可以用来得到“FRET效率”。但是这个测量中一个潜在的问题是FRET激发的供体强度不能直接测量。而且由于供体的荧光和受体的荧光之间有重叠,所以会发生“供体渗漏”,测得的供体荧光信号会有一部分来自于受体分子。如果想要得到高精度的结果,稳态FRET技术就要用只含有供体和受体的样本来进行精细的校准。
另一个问题是标记的化学计量。理想情况下,对于每一个受体分子和供体分子应该精确的标记,即不存在没有标记的分子,也不存在有超过一个标记的分子。这在实际中可能会实现。但是如果受体没有充分标记,我们得到的FRET效率就不能正确的反应供体与受体之间的距离。而如果对受体分子的标记处于过饱和状态,校正直接激发的受体荧光就非常困难。试验中甚至可能会发生供体与数个受体相结合的事情。这也会增加FRET效率,但是同时也会导致对于供体与受体之间的距离测量失真。
基于荧光寿命的FRET测量
FLIM FRET技术基于对于供体荧光寿命的测量。在试验中我们可以完全独立于受体荧光的测量供体荧光,这就不存在供体渗漏问题。FRET效率可通过对比独立的供体荧光与FRET中的供体荧光来得到。
图9就显示了一个类似例子。FRET导致的荧光寿命减少清晰可见,如右图的荧光寿命衰减曲线所示。

图9,HEK细胞的FERT。供体和受体分别由CFP和YFP标记。左图是供体的荧光寿命图像,是双指数模型的幅度权重荧光,右图是左图示意部位的荧光寿命衰减曲线。
基于双指数衰减分析FRET测量
基于FLIM的FRET测量的最大优势就是FLIM可以区分反应和没有反应的供体的数目。有若干原因会导致供体不会与受体反应。一个小小的原因就是供体或者受体分子可能没有正确的标记。另外一个可能的原因是受体分子和供体分子的取向是随机的,当供体分子垂直于受体分子时,它们不会发生相互作用。这个问题对于FRET效率计算的影响一般会通过引入“κ
2因子”来解决。
一个更重要原因是试验中的蛋白质通常是活性与非活性蛋白质的混合物。活性蛋白质所占的分数以及蛋白质之间的距离都会影响传统的FRET效率。因此我们无法从传统的FRET效率不同中得知这是由于供体受体距离之间的不同还是活性蛋白质的分数不同造成的。
而TCSPC FLIM解决了双指数衰减分析的问题。我们可以通过一个双指数模型来拟合供体的荧光寿命衰减曲线,这两个指数包括一个未淬灭长寿命的非活性组分以及一个淬灭短寿命的活性组分。如果标记完全,比如在GFP变体的细胞表达融合蛋白试验中,经过κ
2因子校正的衰减组分会正确的得到反应活性与非活性蛋白质的组分。图10表达了受体衰减函数的组成。
双指数衰减分析可以得到非活性与活性组分的荧光寿命τ
0和τ
FRET,以及它们的幅度a
1和a
2。从这些参数可以推算出活性蛋白的真实FRET效率,距离分布,Förster半径,以及活性与非活性供体分子的比率。请注意在这个实验中不需要再测量来自于一个只含有供体的细胞的参考荧光寿命数据。参考荧光寿命数据既是τ
0,受体中慢衰减组分的荧光寿命。这样得到的τ
0和τ
FRET来自于同样的细胞环境。因此在合理的限制下双指数FRET得到的荧光寿命独立于环境变化所引起的荧光寿命变化。
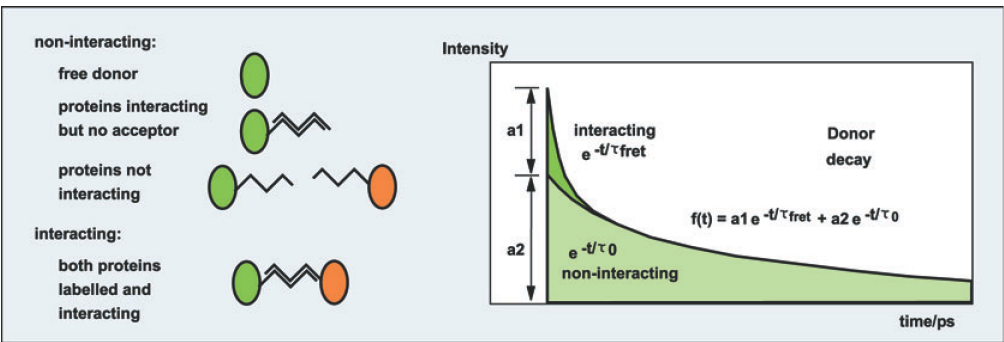
图10,FRET系统的荧光衰减组分。
图11是图9中细胞的双指数分析示例。左图表示了非活性和活性供体荧光寿命分数比τ
0/τ
FRET。τ
0/τ
FRET在左图显示了不同区域的比率,不同区域内的最大差别是10%,对应的距离差距只有2%。但是强度因子的差距,a
1/a
2,在10倍的数量级上。而得到的结果表明图9中的单指数荧光寿命的涨落来自于活性蛋白比例的改变,而不是距离的改变。换而言之,把单指数荧光寿命(或者来自于稳态实验的经典FRET效率)的变化仅仅理解为距离的变化是错误的。
双指数衰减行为最先是在多维TCSPC的FRET试验中发现的,在条纹相机测量中也证实了双指数衰减曲线。这雄辩地证明了双指数衰减是来自于活性与非活性的供体组分。
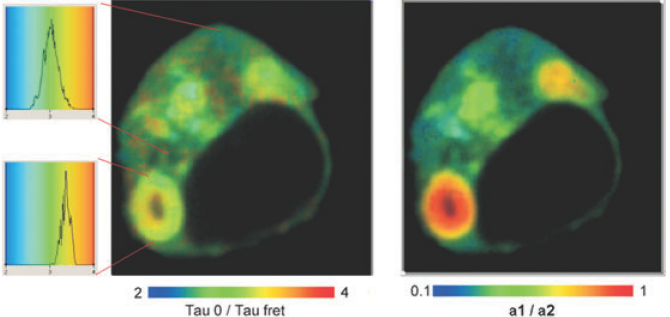
图11,双指数荧光寿命分析FRET结果。左图,τ
0/τ
FRET,右图,活性供体与非活性供体的幅度比a
1/a
2。
双指数衰减曲线对于利用FLIM数据来计算传统(稳态)的FRET效率有影响。双指数衰减曲线不能用一个荧光寿命来描叙。为了得到正确的能量转移效率,必须使用两个荧光寿命组分的幅度权重平均来计算。幅度权重平均不同于单指数拟合得到的荧光寿命。因此,我们只能用双指数衰减分析得到正确(传统)的FRET效率。
需要指出的是FRET实验存在着一些缺陷:化学计量可能是错的,被正确标记的供体可能会与没有正确标记的受体反应,或者受体分子被过度标记导致供体分子会与几个不同的受体反应。供体也有可能会含有多指数衰减函数,或者供体信号中含有一部分的自发荧光,又或者试验中一部分受体会被光漂白。此外固定细胞内的FRET测量可能会发生问题。固定不仅仅会改变蛋白的构象,也会引起不可预测的荧光寿命改变和供体的多指数衰减行为。解决这些问题没有必要用到FLIM,但是FLIM可以用来定位如何解决这些问题。
自发荧光
大多数内源性荧光团的荧光衰减时间取决于蛋白质的连接,所述组织的代谢状态,氧浓度,和其它生物的相关参数。因此通过自发荧光的衰减函数可以得到代谢状态和组织构造的信息。
由于目前使用的几种荧光团与荧光团组分的自发组织荧光的衰减曲线是多指数的,衰减的组分从100 ps到几ns不等。在利用多光子显微镜的FLIM数据中可能还会存在来自于SHG的部分。由于SHG是一个超快的过程,它会表现为一个无限快的衰减组分。
从图13可以看到单指数衰减的偏差巨大。为了从数据中提取有意义的衰减参数,需要通过高时间分辨率,足够数量的时间通道以及双指数和三指数衰减曲线分析模型。
来自于NADH和FAD荧光信号的临床影像格外有趣
。我们已经知道NADH和FAD的荧光寿命取决于与蛋白质的结合。结合和未结合NADH的比率取决于代谢状态,NADH和FAD的荧光强度比取决于氧化还原状态。
我们已经用NADH和FAD的FLIM数据来检测癌前期和癌性的改变。皮肤损伤和眼底的病变也会带来各种荧光衰减参数的变化。
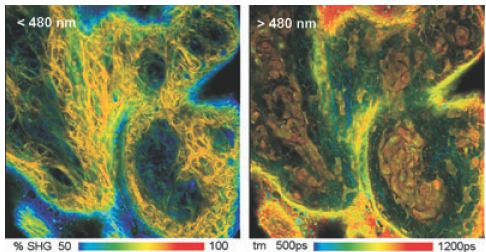
图12,猪皮的双光子FLIM,非退扫描双光子激发检测。左图,波长小于480 nm,颜色标识了信号中SHG的百分比,右图信号通道大于480 nm,颜色标识了幅度权重平均荧光寿命。实验用的显微镜是蔡司的LSM 710 NLO,TCSPC系统是Simple-Tau 152 FLIM双通道 FLIM 系统。
试验中同样发现NADH荧光衰减指数受到诸如细胞的成熟,干细胞分化,以及在细胞凋亡和坏死这类事件的影响。图12-16就显示了这些自发荧光寿命的例子。
图12和14中表示了详细的组织自发荧光FLIM数据可以多么丰富。这张图片是由800nm的双光子激发的猪皮自发荧光数据。试验中用蔡司的LSM 710 NLO显微镜进行非退扫描探测,用Becker & Hickl的Simple-Tau 152 FLIM双通道 FLIM 系统同时记录两个波长范围的信号。左图的波长小于480 nm,通道里面既有荧光信号又有SHG信号,荧光信号和SHG信号的强度比指示了皮肤的状态。这样我们可以将SHG信号从FLIM数据中分离出来,用颜色标识它的相对强度。右图是信号通道大于480 nm,它只有荧光信号。我们通过双指数模型来分析它,颜色标识了幅度权重平均荧光寿命。图14标识了快速衰减组分的荧光寿命、快速衰减组分的幅度以及慢速衰减组分的荧光寿命。
图15显示了一个活的干细胞的荧光寿命图像。我们使用波长为750nm的双光子激发,探测的荧光波长范围是400到480nm。在这个范围内基本都是NADH荧光。从图中可以看出,分化的细胞a
1/a
2幅度较低,而幅度权重荧光寿命较长。
图16是老鼠脑内胶质瘤细胞的图像,可以看到胶质瘤细胞的荧光寿命较健康细胞较长。
结束语
FLIM还存在一些问题-和很多高端探测技术一样。最显著的一个问题是光漂白。乍一看可能会觉得FLIM试验中光漂白的影响不会很显著:FLIM与浓度独立。如果有一部分的荧光团受到了光漂白,我们利用剩下没有光漂白的荧光团依然可以得到正确的荧光寿命。但是问题在于试验中存在着不同的荧光团,或者在不同的环境下有活性的荧光团分数不同。这就导致了不同区域的光漂白程度不一致,让荧光衰减曲线的组成也随之改变。而FLIM实验中需要记录大量光子加剧了这个事实。对于指定的光子数目而言,荧光寿命图像的信噪比和强度图像的信噪比一致。不过为了得到同样质量的图像,荧光寿命的信噪比容忍度要小于强度比图像的。所以荧光寿命图像需要更多的光子。而典型的FLIM试验中,荧光团都是依赖于特定的标记物这一事实也加剧了这个光漂白的影响。这就意味着,荧光团浓度较低。对于给定数目的光子,分子必须历经更多激发发光周期,因此,会导致更快光漂白。
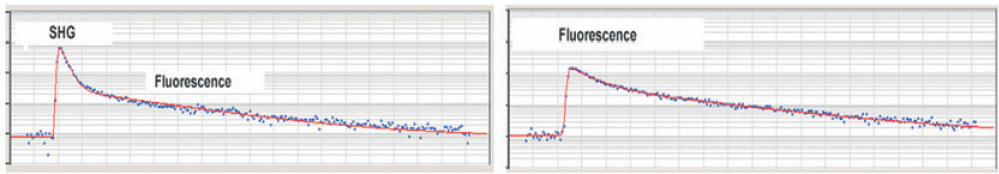
图13,来自于图12中3*3像素区域的荧光衰减曲线。

图14,波长大于480 nm的通道,快速衰减组分的荧光寿命曲线,t
1,快速衰减组分的幅度,a
1,以及慢速衰减组分的荧光寿命,t
2。
FLIM系统的改进仅仅可能来自于探测效率的改进。这样做的一个办法是使用正确的光学系统。一个坏消息是多光子显微镜的非退扫描在传输散射光子时效率很低。同时不必要的使用低数值孔径显微镜也会导致效率的降低。另外一个关键的因素就是探测器。早期的FLIM系统使用的是高速光电倍增管、影像增强器与传统的光阴极管,这样结合导致探测效率不会超过15%。如果使用单光子雪崩光电二极管可以得到更高的效率。但是这些探测器的探测区域太小,无法在多光子显微镜系统中实现非退扫描。而探测器的突破来自于GaAsP阴极混合探测器的使用。这样的探测器也克服了光漂白的问题,甚至Z轴组织自发荧光的FLIM也成为了可能。

图15,人类涎腺干细胞的FLIM图像。分化的细胞具有显著低的a
1/a
2比例和更长的平均寿命。
尽管基于FLIM的出版文献数目日益增长,FLIM还是有待开发的潜力。大多数荧光团都根据其被标记物的不同而表现出不同的荧光寿命。但是几乎没有把这些荧光团作为生物相关参数指针的实验。在FRET应用中,FLIM可以用在供体与受体荧光有较小的光谱差距情形下,甚至是非荧光受体。这样可以研制出具有相当高的FRET效率的新供体-受体对。此外,FLIM可能会是医疗诊断新方法。在眼科和皮肤科中的FLIM实用以及处在临床试验的状态了。第一个临床的FLIM系统已经或者即将推向市场。此外还有利用散射光学 (光子迁移) 技术的临床应用。这些技术利用的是近红外区域。因此对于近红外染料和其在细胞级别上的影响的研究日益热门。或许在不久的将来会出现近红外的FLIM显微镜。

图16,老鼠脑内的胶质瘤细胞荧光寿命图。A,连续颜色标识的荧光寿命图像;B,离散色阶标识的荧光寿命;C,强度图像。右图,不同激发波长下不同种类细胞的荧光寿命图像。
FLIM系统能否与诸如随机光重建显微镜(STORM)、光活化本地化显微镜(PALM)、受激发射损耗显微镜(STED)、近场扫描光学显微镜(NSOM)、或者全内反射技术(TIRF)等超分辨显微镜联用也是一个研究方向。STORM和PALM需要可切换的荧光,我们目前还不清楚它们的荧光寿命是否传递了生物信息,同时这些技术需要相当高像素的宽场探测器。如果想把STORM或者PALM技术与FLIM技术联用,可能还需要等待更加便于切换的荧光团和精度更高的时间分辨探测器。而STED使用单点探测器扫描,Auksorius报道了STED和FLIM的联用。NSOM技术也是同样基于扫描的,所以Cadby等人发现NSOM和FLIM的联用也是显而易见的。TIRF既可以基于宽场激发探测,也可以基于单点探测。这两种变种都可以与FLIM技术联用。
由于代谢的原因,生物体经常存在非常快的动力学过程。我们可以通过记录快速FLIM时间序列来研究这些过程。然而,随着记录速度的加快,光子预算的问题也随之而来。我们可以使用诸如样品的重复刺激和触发时间序列累计这样的技术来改善这些问题。TCSPC在这些方面的应用包括荧光寿命过渡态扫描,相似的原理也可以用于其他的FLIM技术。此外,我们还可以使用数据密集型方式记录一个快速FLIM时间系列数据,以及分析该系列的所述时间数据。这样我们对于每个独立步骤的成像光子数需求就会降低。
我们可以用各向异性衰减成像和光漂白后恢复荧光(FRAP)技术来记录细胞中的旋转和横向扩散过程。双通道FLIM系统都可以记录各向异性FLIM。试验中所需要加的附件仅仅是一个分离极性荧光信号的偏振片。通过记录光漂白样品一个区域内一小段时间的信号,FRAP就可以与FLIM联用。而FRAP试验中的荧光寿命是否包含着有用的信息还需要我们进一步的发掘。
参考文献:
Agronskaia, A.V., Tertoolen, L. & Gerritsen, H.C. (2003) High frame rate fluorescence lifetime imaging. J. Phys. D: Appl. Phys. 36, 1655–1622.
Auksorius, E., Boruah, B.R., Dunsby, C., Lanigan, P.M.P., Kennedy, G., Neil, M.A.A. & French, P.M.W. (2008) Stimulated emission depletion microscopy with a supercontinuum source and fluorescence lifetime imaging. Opt. Lett. 33, 113–115.
Bacskai, B.J., Skoch, J., Hickey, G.A., Allen, R. & Hyman, B.T. (2003) Fluorescence resonance energy transfer determinations using multiphoton fluorescence lifetime imaging microscopy to characterize amyloid-beta plaques. J. Biomed. Opt. 8, 368–375.
Ballew, R.M. & Demas, J.N. (1989) An error analysis of the rapid lifetime determination method for the evaluation of single exponential decays. Anal. Chem. 61, 30–33.
Becker, W. (2005) Advanced Time-Correlated Single-Photon Counting Techniques. Springer, Berlin/Heidelberg/New York.
Becker, W. (2010) The bh TCSPC Handbook, 4th edn. Becker & Hickl GmbH, Berlin at available on www.becker-hickl.com.
Becker,W.&Bergmann,A.(2008)Lifetime-resolved imaging in nonlinear microscopy. In: Handbook of Biomedical Nonlinear Optical Microscopy (ed. by B.R. Masters & P.T.C So), Oxford University Press, Oxford, NY, pp. 499–556.
Becker, W., Bergmann, A., Biskup, C., Zimmer, T., Kl¨ocker, N. & Benndorf, K. (2002) Multi-wavelength TCSPC lifetime imaging. Proc. SPIE 4620, 79–84.
Becker, W., Bergmann, A., Hink, M.A., K¨onig, K., Benndorf, K. & Biskup, C. (2004a) Fluorescence lifetime imaging by time-correlated single photon counting. Microsc. Res. Tech. 63, 58–66.
Becker, W., Bergmann, A., Biscotti, G., K¨onig, K., Riemann I., Kelbauskas, L. & Biskup, C. (2004b) High-speed FLIM data acquisition by time-correlated single photon counting. Proc. SPIE 5323, 27–35.
Becker, W., Bergmann, A., Haustein, E. et al. (2006) Fluorescence lifetime images and correlation spectra obtained by multi-dimensional TCSPC. Microsc. Res. Tech. 69, 186–195.
Becker, W., Bergmann, A. & Biskup, C. (2007) Multi-spectral fluorescence lifetime imaging by TCSPC. Microsc. Res. Tech. 70, 403–409.
Becker, W., Su, B. & Bergmann, A. (2009) Fast-acquisition multispectral FLIM by parallel TCSPC. Proc. SPIE 7183, 7183051–5.
Becker, W., Su, B., Weisshart, K. & Holub, O. (2011a) FLIM and FCS detection in laser-scanning microscopes: increased efficiency by GaAsP hybrid detectors. Microsc. Res. Tech. 74, 804–811.
Becker, W., Su, B., Bergmann, A., Weisshart, K. & Holub, O. (2011b) Simultaneous fluorescence and phosphorescence lifetime imaging. Proc. SPIE 7903, 790320-1–7.
Becker, W., Su, B. & Bergmann, A. (2012) Spatially resolved recording of transient fluorescence-lifetime effects by line-scanning TCSPC. Proc. SPIE 8226, 82260C-1–6.
Benesch, J., Hungerford, G., Suhling, K., Tregidgo, C., Mano, J.F. &Reis, R.L. (2007) Fluorescence probe techniques to monitor protein adsorption-induced conformation changes on biodegradable polymers. J. Colloid Interface Sci. 312, 193–200.
Berezin, M.Y. & Achilefu, S. (2010) Fluorescence lifetime measurement and biological imaging. Chem. Rev. 110, 2641–2684.
Bird, D.K., Eliceiri, K.W., Fan, C-H. & White, J.G. (2004) Simultaneous two-photon spectral and lifetime fluorescence microscopy. Appl. Opt.43, 5173–5182.
Bird, D.K., Yan, L., Vrotsos, K.M., Eliceiri, K. E. & Vaughan, E. M. (2005) Metabolic mapping of MCF10A human breast cells via multiphoton fluorescence lifetime imaging of coenzyme NADH. Cancer Res. 65, 8766–8773.
Biskup, C., Zimmer, T. & Benndorf, K. (2004a) FRET between cardiac Na+ channel subunits measured with a confocal microscope and a streak camera. Nat. Biotechnol. 22, 220–224.
Biskup, C., Kelbauskas, L., Zimmer, T., et al. (2004b) Interaction of PSD-95 with potassium channels visualized by fluorescence lifetime-based resonance energy transfer imaging. J. Biomed. Opt. 9, 735–759.
Biskup, C., Zimmer, T., Kelbauskas, L., Hoffmann, B., Kl¨ocker, N., Becker, W., Bergmann, A. & Benndorf, K. (2007) Multi-dimensional fluorescence lifetime and FRET measurements. Microsc. Res. Tech. 70, 403–409.
Booth,M.J.&Wilson,T.(2004)Low-cost, frequency-domain, fluorescence lifetime confocal microscopy. J. Microsc. 214, 36–42.
Buurman, E.P., Sanders, R., Draaijer, A., Gerritsen, H.C., van Veen, J.J.F., Houpt, P.M. & Levine, Y.K. (1992) Fluorescence lifetime imaging using a confocal laser scanning microscope. Scanning 14, 155–159.
Cadby, A., Dean, R., Fox, A.M., Jones, R.A.L., & Lidzey D.G. (2005) Mapping the fluorescence decay lifetime of a conjugated polymer in a phase-separated blend using a scanning near-field optical microscope. Nano Lett. 5, 2232–2237.
Cade, N.I., Fruhwirth, G., Archibald, S. J., Ng, T. & Richards, D. (2010) A cellular screening assay using analysis of metal-modified fluorescence lifetime. Biophys. J. 98, 2752–2757.
Calleja, V., Ameer-Beg, S., Vojnovic, B., Woscholski, R., Downwards, J. & Larijani, B. (2003) Monitoring conformational changes of proteins in cells by fluorescence lifetime imaging microscopy. Biochem. J. 372, 33–40.
Chance, B. (1976) Pyridine nucleotide as an indicator of the oxygen requirements for energy-linked functions of mitochondria. Circ. Res. 38, I31–I38.
Chance, B., Schoener, B., Oshino, R., Itshak, F. & Nakase, Y. (1979) Oxidation–reduction ratio studies of mitochondria in freeze-trapped samples. NADH and flavoprotein fluorescence signals. J. Biol. Chem.254, 4764–4771.
Chen, Y. & Periasamy, A. (2004) Characterization of two-photon excitation fluorescence lifetime imaging microscopy for protein localization. Microsc. Res. Tech. 63, 72–80.
Chia, T.H., Williamson, A., Spencer, D.D. & Levene, M.J. (2008) Multiphoton fluorescence lifetime imaging of intrinsic fluorescence in human and rat brain tissue reveals spatially distinct NADH binding. Opt. Express 16, 4237–4249.
Chorvat, D. & Chorvatova, A. (2006) Spectrally resolved time-correlated single photon counting: a novel approach for characterization of endogenous fluorescence in isolated cardiac myocytes. Eur. Biophys. J. 36, 73–83.
Chorvat, D. & Chorvatova, A. (2009) Multi-wavelength fluorescence lifetime spectroscopy: a new approach to the study of endogenous fluorescence in living cells and tissues. Laser Phys. Lett. 6,175–193.
Cole, M.J., Siegel, J., Webb, S.E.D., et al. (2001) Time-domain whole-field lifetime imaging with optical sectioning. J. Microsc. 203, 246–257.
De Beule, P., Owen, D.M., Manning, H.B. et al. (2007) Rapid hyperspectral fluorescence lifetime imaging. Microsc. Res. Tech. 70, 481–484.
Denk, W., Strickler, J.H., Webb, W.W.W. (1990) Two-photon laser scanning fluorescence microscopy. Science 248, 73–76.
Diaspro, A. (ed.) (2001) Confocal and Two-Photon Microscopy: Foundations, Applications and Advances. Wiley-Liss, Inc., New York.
Digman, M.A., Caiolfa, V.R., Zamai, M. & Gratton, E. (2008) The phasor approach to fluorescence lifetime imaging analysis. Biophys. J. 94, L14–L16.
Dimitrow, E., Riemann, I., Ehlers, A., Koehler, M., Norgauer, J., Elsner, P., K¨onig, K. & Kaatz, M. (2009) Spectral fluorescence lifetime detection and selective melanin imaging by multiphoton laser tomography for melanoma diagnosis. Exp. Dermatol. 18, 509–515.
Dowling, K., Hyde, S.C.W., Dainty, J.C., French, P.M.W. & Hares, J.D. (1997) 2-D fluorescence liefetime imaging using a time-gated image intensifier. Opt. Commun. 135, 27–31.
Duncan, R.R., Bergmann, A., Cousin, M.A., Apps, D.K. & Shipston, M.J. (2004) Multi-dimensional time-correlated single-photon counting (TCSPC) fluorescence lifetime imaging microscopy (FLIM) to detect FRET in cells. J. Microsc. 215, 1–12.
Dymoke-Bradshaw, A.K.L. (1992) The impact of high-voltage pulse technology on high-speed photography. Proc. SPIE 1757, 2–6.
Ellis, J.D., Ll`eres, D., Denegri, M., Lamond, A.I. & C´aceres, J.F. (2008) Spatial mapping of splicing factor complexes involved in exonandintron definition. J. Cell Biol. 181, 921–934.
Elson, D.S., Munro, I., Requejo-Isidro, J. et al. (2004) Real-time time-domain fluorescence lifetime imaging including single-shot acquisition with a segmented optical image intensifier. New J. Phys. 6, 180–192.
Felekyan, S., K ¨uhnemuth, R., Kudryavtsev, V., Sandhagen, C., Becker, W.& Seidel, C.A.M. (2005) Full correlation from picoseconds to seconds by time-resolved and time-correlated single photon detection. Rev. Sci. Instrum. 76, 083104-1–14.
F¨orster, Th. (1946) Energiewanderung und Fluoreszenz. Naturwissenschaften 6, 166–175.
F¨orster, Th. (1948) Zwischenmolekulare Energiewanderung und Fluoreszenz. Ann. Phys. Ser. 62, 55–75.
Forster, Th. (2012) Energy migration and fluorescence. Translated by Klaus Suhling. J. Biomed. Opt. 7, 011002 (2012).
Funk, K., Woitecki, A., Franjic-W ¨urtz, C., Gensch, Th., M¨ohrlein, F. &Frings, S. (2008) Modulation of chloride homeostasis by inflammatory mediators in dorsal ganglion neurons. Mol. Pain 4, 32–43.
Gerritsen, H.C., Asselbergs, M.A.H., Agronskaia, A.V. & van Sark, W.G.J.H.M. (2002) Fluorescence lifetime imaging in scanning microscopes: acquisition speed, photon economy and lifetime resolution. J. Microsc. 206, 218–224.
Ghukassian, V. & Kao, F.-J. (2009) Monitoring cellular metabolism with fluorescence lifetime of reduced nicotinamide adenine dinucleotide. J.Phys. Chem. C 113, 11532–11540.
Gilbert, D., Franjic-W¨urtz, C., Funk, K., Gensch, Th., Frings, S. & M¨ohrlen, F. (2007) Differential maturation of chloride homeostasis in primary afferent neurons of the somatosensory system. Int. J. Dev. Neurosci. 25,479–489.
Gordon, G.W., Berry, G., Liang, X.H., Levine, B. & Herman, B. (1998) Quantitative fluorescence resonance energy transfer measurements using fluorescence microscopy. Biophys. J. 74, 2702–2713.
Graham, D.L., Lowe, P.N. Chalk, P.A. (2001) A method to measure the interaction of Rac/Colc 42 with their binding partners using fluorescence resonance energy transfer between mutants of green fluorescent protein. Anal. Biochem. 296, 208–217.
Gratton, E. & Barbieri, B.B. (1986) Multifrequency phase fluorometry using pulsed sources: theory and applications. Spectroscopy 1, 28–36.
Gratton, E., Breusegem, S., Sutin, J., Ruan, Q. & Barry, N. (2003) Fluorescence lifetime imaging for the two-photon microscope: time-domain and frequency domain methods. J. Biomed. Opt. 8, 381–390.
Guo, H.-W., Chen, C.-T., Wei, Y.-H., Lee, O.K., Gukassyan, V., Kao, F.-J. & Wanga, H.-W. (2008) Reduced nicotinamide adenine dinucleotide fluorescence lifetime separates human mesenchymal stem cells from differentiated progenies. J. Biomed. Opt. 13 050505-1–3.
Hanson, K.M., Behne, M.J., Barry, N.P., Mauro, T.M. & Gratton, E. (2002) Two-photon fluorescence imaging of the skin stratum corneum pH gradient. Biophys. J. 83, 1682–1690.
Hink, M.A., Visser N.V., Borst, J.W. van Hoek, A. & Visser, A.J.W.G. (2003) Practical use of corrected fluorescence excitation and emission spectra of fluorescent proteins in F¨orster resonance energy transfer (FRET) studies. J. Fluoresc. 13(2), 1–4.
Hoffmann, B., Zimmer, T, Kl¨ocker, N., Kelbauskas, L., K¨onig, K., Benndorf, K. & Biskup, C. (2008) Prolonged irradiation of enhanced cyan fluorescent protein or Cerulean can invalidate F¨orster resonance energy transfer measurements. J. Biomed. Opt. 13, 031250-1–9.
Kaneko, H., Putzier, I., Frings, S., Kaupp, U.B., & Gensch, Th. (2004) Chloride accumulation in mammalian olfactory sensory neurons. J. Neurosci. 24, 7931–7938.
Kantelhardt, S.R., Leppert, J., Krajewski, J., Petkus, N., Reusche, E., Tronnier, V.M., H¨uttmann, G., & Giese, A. (2007) Imaging of brain and brain tumor specimens by time-resolved multiphoton excitation microscopy ex vivo. Neuro-Onkology 9, 103–112.
Katsoulidou, V., Bergmann, A., & Becker, W. (2007) How fast can TCSPC FLIM be made? Proc. SPIE 6771, 67710B-1–7.
Kelbauskas, L. & Dietel, W. (2002) Internalization of aggregated photosensitizers by tumor cells: Subcellular time-resolved fluorescence spectroscopy on derivates of pyropheophorbide-a ethers and chlorine6 under femtosecond one- and two-photon excitation. Photochem.Photobiol. 76, 686–694.
Kemnitz,K.(2001)Picosecond fluorescence lifetime imaging spectroscopy as a new tool for 3D structure determination of macro molecules in living cells, In: New Trends in Fluorescence Spectroscopy (ed. by B. Valeur & J.C. Brochon), Springer Verlag, Berlin/Heidelberg/New York, pp. 381–410.
Koehler, M.J., K¨onig, K., Elsner, P., B ¨uckle, R. & Kaatz, M. (2006) In vivo assessment of human skin aging by multiphoton laser scanning tomography. Opt. Lett. 31, 2879–2881.
K¨ollner, M. & Wolfrum, J. (1992) How many photons are necessary for fluorescence-lifetime measurements? Phys. Chem. Lett. 200, 199–204.
K¨onig, K. (2008) Clinical multiphoton tomography. J. Biophoton. 1, 13–23.
K¨onig, K. & Riemann, I. (2003) High-resolution multiphoton tomography of human skin with subcellular spatial resolution and picosecond time resolution. J. Biom. Opt. 8, 432–439.
K¨onig, K. & Uchugonova, A. (2009) Multiphoton fluorescence lifetime imaging at the dawn of clinical application. In: FLIM Microscopy in Biology and Medicine (ed. by A. Periasamy & R.M. Clegg), CRC Press Taylor & Francis Group, Boca Raton, FL, pp. 165–187.
K¨onig, K., Uchugonova, A. & Gorjup, E. (2011) Multiphoton fluorescence lifetime imaging of 3D-stem cell spheroids during differentaition. Microsc. Res. Tech. 74, 9–17.
Koushik, S.V. & Vogel, S.S. (2008) Energy migration alters the fluorescence lifetime of Cerulean: implications for fluorescence lifetime imaging Forster resonance energy transfer measurements. J. Biomed. Opt. 13, 031204-1–9.
Krishnan, R.V., Saitoh, H., Terada, H., Centonze, V.E. & Herman, B. (2003) Development of a multiphoton fluorescence lifetime imaging microscopy (FLIM) system using a streak camera. Rev. Sci. Instrum. 74,2714–2721.
Kuchibhotla, K.V., Lattarulo, C.R., Hyman, B. & Bacskai, B.J. (2009) Synchronous hyperactivity and intercellular calcium waves in astrocytes in Alzheimer mice. Science 323, 1211–1215.
Kuimova, M.K., Yahioglu, G., Levitt, J.A. & Suhling, K. (2008) Molecular rotor measures viscosity of live cells via fluorescence lifetime imaging. J. Am. Chem. Soc. 130, 6672–6673.
Kumar, S., Dunsby, C., De Beule, P.A.A. et al. (2007) Multifocal multiphoton excitation and time correlated single photon counting detection for 3-D fluorescence lifetime imaging. Opt. Expr. 15, 12548–12561.
Lakowicz, J.R. (2006) Principles of Fluorescence Spectroscopy, 3rd ed. Springer, Berlin, Heidelberg, New York.
Lakowicz, J.R. & Berndt, K. (1991) Lifetime-selective fluorescence lifetime imaging using an rf phase-sensitive camera. Rev. Sci. Instrum. 62,1727–1734.
Lakowicz, J.R., Szmacinski, H., Nowaczyk, K. & Johnson, M.L. (1992) Fluorescence lifetime imaging of free and protein-bound NADH. PNAS 89, 1271–1275.
Lebedev, A.Y., Cheprakov, A.V., Sakadzic, S., Boas, D.A., Wilson, D.F. & Vinogradov, S.A. (2009) Dendritic phosphorescent probes for oxygen imaging in biological systems. Appl. Mater. Interfaces 1, 1292–1304.
Leppert, J., Krajewski, J., Kantelhardt, S.R., Schlaffer, S., Petkus, N., Reusche, E., H¨uttmann, G. & Giese, A. (2006) Multiphoton excitation of autofluorescence for microscopy of glioma tissue. Neurosurgery 58,759–767.
Levitt, J.A., Kuimova, M.K., Yahioglu, G., Chung, P.-H., Suhling, K. & Phillips, D. (2009a) Membrane-bound molecular rotors measure viscosity in live cells via fluorescence lifetime imaging. J. Phys. Chem. C 113, 11634–11642.
Levitt, J.A., Matthews, D.R., Ameer-Beg, S.M. & Klaus Suhling, K. (2009b) Fluorescence lifetime and polarization-resolved imaging in cell biology. Curr. Opin. Biotechnol. 20, 28–36.
Lin, L.L., Grice, J.E., Butler, M.K. et al. (2011) Time-correlated single photon counting for simultaneous monitoring of zinc oxide nanoparticles and NAD(P)H in intact and barrier-disrupted volunteer skin. Pharm Res. 28, 2920–2930.
Malicka, J., Gryczynski, I., Geddes, C.D. & Lakowicz, J.R. (2003) Metal-enhanced emission from indocyanine green: a new approach to in vivo imaging. J. Biomed. Opt. 8, 472–478.
Masters, B.R. & So, P.T.C. (2008) Handbook of Biomedical Nonlinear Optical Microscopy. Oxford University Press, Oxford, New York.
Mitchell, A.C., Wall, J.E., Murray, J.G. & Morgan, C.G. (2002a) Measurement of nanosecond time-resolved fluorescence with a directly gated interline CCD camera. J. Microsc. 206, 233–238.
Mitchell, A.C., Wall, J.E., Murray, J.G. & Morgan, C.G. (2002b) Direct modulation of the effective sensitivity of a CCD detector: a new approach to time-resolved fluorescence imaging. J. Microsc. 206, 225–232.
Muddana, H.S., Morgan, T.T., Adair, J.H. & Butler, P.J. (2009) Photophysics of Cy3-encapsulated calcium phosphate nanoparticles.Nano Lett. 9, 1559–1556.
O’Connor, D.V. & Phillips, D. (1984) Time-Correlated Single Photon Counting. Academic Press, London.
Patterson, G.H., Piston, D.W., & Barisas, B.G. (2000) F¨orster distances between green fluorescent protein pairs. Anal. Biochem. 284, 438–440.
Paul, R.J. & Schneckenburger, H. (1996) Oxygen concentration and the oxidation-reduction state of yeast: determination of free/bound NADH and flavins by time-resolved spectroscopy. Naturwissenschaften 83, 32–35.
Pawley, J. (2006) Handbook of Biological Confocal Microscopy. 3rd ed. Springer.
Periasamy, A. (2001) Methods in Cellular Imaging. Oxford University Press, Oxford, New York.
Periasamy, A. & Clegg, R.M. (2009) FLIM Microscopy in Biology and Medicine. CRC Press, Taylor & Francis Group, Boca Raton, Fl, pp. 165–187.
Peter, M. & Ameer-Beg, S.M. (2004) Imaging molecular interactions by multiphoton FLIM. Biol. Cell 96, 231–236.
Petrasek, Z. & Suhling, K. (2010) Photon arrival timing with sub-camera exposure time resolution in wide-field time-resolved photon counting imaging. Opt. Express 18(24), 24889–24901
Philip, J.P. & Carlsson, K. (2003) Theoretical investigation of the signal-to-noise ratio in fluorescence lifetime imaging. J. Opt. Soc. Am. A20, 368–379.
Provenzano, P.P., Rueden, C.T., Trier, S.M., Yan, L., Ponik, S.M., Inman, D.R., Keely, P.J. & Eliceiri, K.W. (2008) Nonlinear optical imaging and spectral-lifetime computational analysis of endogenous and exogenous fluorophores in breast cancer. J. Biomed. Opt. 13, 031220-1–11.
Prow, T.W., Grice, J.E., Lin, L.L. et al. (2011) Nanoparticles and microparticles for skin drug delivery. Adv. Drug. Deliv. Rev. 63, 470–491.
Prummer, M., Sick, B., Renn, A. & Wild, U.P. (2004) Multiparameter microscopy and spectroscopy for single-molecule analysis. Anal. Chem. 76, 1633–1640.
Richards-Kortum, R., Drezek, R., Sokolov, K., Pavlova, I. & Follen, M. (2003) Survey of endogenous biological fluorophores. In: Handbook of Biomedical Fluorescence (ed. by M.A. Mycek, B.W. Pogue), pp. 237–264.
Marcel Dekker Inc. New York, Basel. Ritman-Meer, T., Cade, N.I. & Richards, D. (2007) Spatial imaging of modifications to fluorescence lifetime and intensity by individual Ag nanoparticles. Appl. Phys. Lett. 91, 123122-1–3.
Roberts, M.S., Dancik, Y., Prow, T.W., et al. (2011) Non-invasive imaging of skin physiology and percutaneous penetration using 5D (space, time and anisotropy) fluorescence spectral and lifetime imaging with multiphoton and confocal microscopy. Eur. J. Pharm. Biopharm. 77, 469–488.
Rowley, M.I., Barber, P.R., Coolen, A.C.C. & Vojnovic, B. (2011) Bayesian analysis of fluorescence lifetime imaging data. Proc. SPIE 7903,790325-1–7.
R ¨uck, A., H¨ulshoff, Ch., Kinzler, I., Becker, W. & Steiner, R. (2007) SLIM: a new method for molecular imaging. Microsc. Res. Tech. 70, 403–409.
Sanchez, W.Y., Prow T.W., Sanchez W.H., Grice, J.E. & Roberts, M.S. (2010) Analysis of the metabolic deterioration of ex vivo skin, from ischemic necrosis, through the imagi















