荧光和磷光寿命成像结合-微秒尺度的FLIM
摘要:我们最新开发了一种可以同时记录荧光寿命成像和磷光寿命成像的激光扫描系统。它基于对具有像素时钟扫描仪的系统同步调制高频脉冲激光,同时用多通道TCSPC采集荧光和磷光信号。在激光开启状态采集荧光信号,在激光关闭状态采集磷光信号。该技术既不需要通过脉冲选取器来降低激光脉冲重复率,也不需要通过高单个脉冲能量的激光来激发磷光。我们可以使用电调节的皮秒二极管激光器,或用标准的共焦和多光子激光扫描显微镜中的AOM来调制激光。
为什么我们需要磷光寿命成像
在远远长于荧光的时间尺度上有为数众多的辐射弛豫机理。磷光就是其中广为人知的一种,磷光的产生机理是有机染料从三重态发射光子。有机染料的磷光在常温下很弱,但是在低温下或者有机染料嵌入固体基质时会很强。镧系络合物和有机钌、铂和钯配合物的磷光很强,而且它们的时间尺度处在毫秒到微秒这个量级之内。它们之中一些配合物的发光会被氧气很强烈的淬灭,这个现象是活细胞成像领域的一个研究热点。这样的氧淬灭机制使得有机染料成为优良的氧浓度指示剂,这个性质也有可能用在FRET受体之上。此外,大量的无机化合物、量子点、纳米粒子和半导体的发光也比较慢,也可以通过磷光寿命成像来研究。
慢衰减成像的技术问题
通过激光扫描技术观测长寿命发光存在一些技术难点:首先是如何激发发光,显然单个激光脉冲的持续时间必须大于发光寿命。钌及其化合物的发光寿命小于1ms,铕和铽染料的发光寿命在毫秒量级内。如果使用未经优化的FLIM技术,就需要激光的重复频率小于100kHz或者100Hz。如何产生如此低频率的重复激光就是一个技术难题。更重要的是,对于给定激光功率的激光器而言,降低重复频率会降低平均激发功率。而为了补偿平均功率的下降而把单个激光脉冲的能量提高不仅仅受到激光器本身性能的限制,也会产生非线性效应,甚至会电离样品。此外,样品发出磷光时也会不可避免的发出荧光。而荧光是一个非常快的过程,这就导致荧光的峰值功率会非常高。这会导致探测器的短暂过载,无法在激光脉冲后的一个微秒内探测磷光。提高单个激光脉冲的功率的一个更好的办法就是加大激光脉冲的宽度。不幸的是,这对大多数激光器都是非常困难的。而且长脉冲时间的激光和多光子激发并不兼容。
第二个问题与采集时间有关。探测器对于激发态样品的采样时间也必须大于样品的发光时间。如果探测器在样品发光时间尚未结束时就结束扫描,我们就损失了发光衰减曲线末端的信号,这样拟合得到的发光衰减曲线就会失真。这样我们就只能通过非常缓慢的扫描得到合理的数据-即使是我们只想得到纯强度的图像也必须如此做。
第三个问题是激光重复频率与像素频率混叠:如果在像素时间内只有几个激励脉冲,激励脉冲中的像素的数目会周期性的变化。这会导致图像中存在摩尔效应(Moiré effects)。我们可以通过同步脉冲激光和像素频率来解决这个问题,但是常规的激光扫描显微镜没有这样的配件(和功能)。如果没有同步,像素时间的长度就必须是激光脉冲时间的一百倍,这样会导致实验时间长度过长。
当然,我们可以使用宽场激发和门控探测器来解决扫描问题。但是这样的方案又会导致无法进行光学切片或者在深度上进行分辨。对于大多数生物学研究来说,这样的方案没有实际的用途。
TCSPC记录与激光脉冲调制
而图1中的激发原理完美的解决了上面的问题。我们使用了高频的脉冲激光,但是这个激光不是连续工作的。它会在每个阶段开始时短暂开启,我们将这段时间称之为t
on。在像素时间的其余阶段,激光是关闭的。在开启时间,t
on,激光会先激发荧光然后是磷光。在剩下的像素驻留时间,我们称之为t
off,我们就可以得到纯磷光的信号。
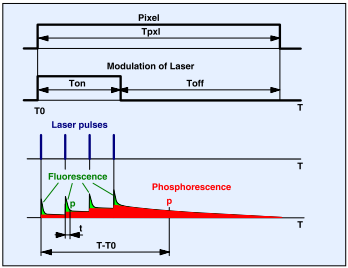
图1,微秒时间尺度FLIM的原理。
我们通过FLIM系统来调制激光,在DCS-120共焦扫描系统里,激光的调制信号由BH的GVD-100扫描控制仪的激光多路复用功能产生。而DCS-120的BDL-SMC的二极管激光是由激光关闭输入来电调制的。
对于其余的显微镜我们会在FLIM系统内加入一个bh的DDG-210。它可以由显微镜的像素时钟来触发和产生激光调制信号,同时通过联用显微镜的阻光信号来产生调制。这样的调制同样可以用在使用Ti:Sa激光器的多光子显微镜上。这样,我们就可以用包括双光子激发和非退扫描探测的组织深度成像在内的实验装置实现微秒时间尺度上的寿命衰减成像。
寿命成像利用了SPC模块的双动力学特征。图2是它的原理。对于每个光子而言,SPC模块可以采集每个激光脉冲内它的时间,t,和调制脉冲后的时间,T-T
0。我们可以通过T
on阶段的光子时间,t,扫描位置,x,y,来建立光子分布,从而得到荧光寿命图像。而磷光寿命图像则是基于调制脉冲后的时间,T-T
0,其中的T为光子时间,T
0为激光湮灭的时间。空间坐标则来自于光子被采集时探测器的位置。这样我们可以通过同一个激光脉冲同时得到荧光和磷光寿命成像。
用BH SPC模块的路由 (或多探测器)模式力可以进行多波长操作。在这种情况下,我们用波长通道对被探测到的光子进行额外的标记。这样我们就可以在独立的波长通道内获得单独的荧光和磷光寿命图像。
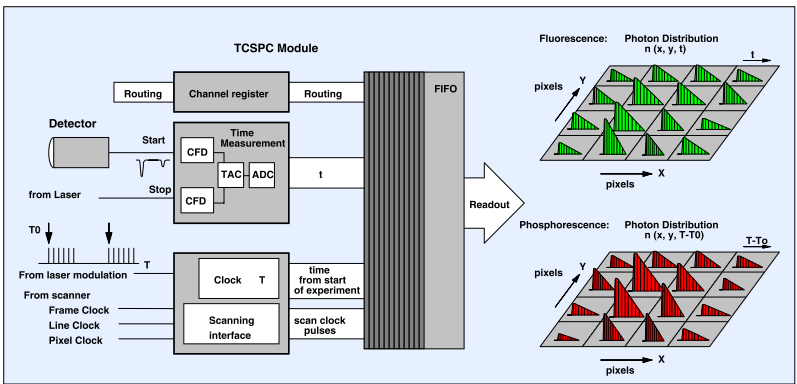
图2,同步的荧光和磷光寿命成像,光子时间是通过激光脉冲周期和激光调制周期确定的。
BH的SPCM软件9.0版本(2010四月)介绍了荧光寿命成像个磷光寿命成像的结合。它适用于生产时间晚于2007年5月的,或者序列号晚于3D0178的SPC-150和SPC-830。
TCSPC系统的参数设置
图3显示了典型的SPC模块的参数设置。用“FIFO image”模式里的MSC(多通道定标器)就可以得到磷光寿命成像。具体的位置如图3中间所示,是System Parameters的Configure行。
MCS图像的时间参考来自于激光调制。必须使用SPC模块的15-pin接口把“Marker”标记与适宜的脉冲连接起来。可以选择三个“Marker”标记中的一个使用。Marker输入的‘Trigger’可以当作时间参考。一般而言,Markers 0,1,2分别对应扫描仪的像素时钟,线时钟和帧时钟,所以时间参考就是Marker 3。当然如果激发脉冲和像素时钟同步,‘Trigger’就可以用像素时钟定义,既Marker 0。如图3右所示,必须要保证System Parameters的More Parameters栏中选定的Marker输入是可用的。
MCS 成像模式的时间通道宽度 (Time per Point) 可以是任何宏观时间周期的倍数。它被定义为宏观时间单位数。‘Points No.’定义了每个像素点的衰减曲线上的点数。而Time per Point和Points No.决定了衰减曲线的时间范围,即‘Time range’表示的时间范围。通过设定光子时间的‘Offset’ 可以移动记录的时间间隔。Offset的设定既可以是正的也可以是负的。
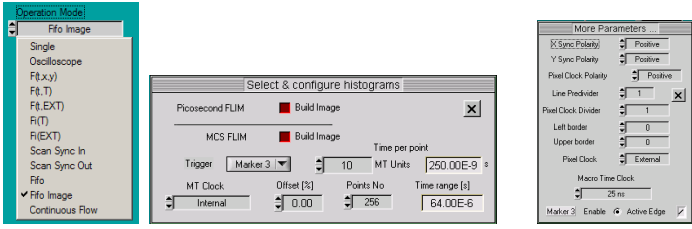
图3,MCS FLIM参数设置,左图,Operation mode;中间,timing parameters和marker selection的设定;右图,其他一些参数的设定(Scan format parameters, macro time clock source, and marker enable)。
一般而言,MCS FLIM记录用的是SPC模块的内部宏观时钟,见图3的中间和右边。当然,对于特殊的应用可以使用SYNC frequency。不过使用SYNC frequency需要SYNC信号在激光关闭的时期内具有稳定的周期。
为了得到皮秒级别的FLIM(不论是否需要同时得到磷光寿命成像)需要激活configuration栏的“ps FLIM”按钮。FLIM的时间参数和正常的SPC模块的TAC参数一致。
激光调制控制
磷光寿命成像需要如图1中像素时钟的同步信号来对激发激光实现开关处理。在Becker & Hickl DCS-120共焦扫描系统的像素同步激光调制是通过扫描控制器已经有的激光复用功能来实现的。DCS系统有两个皮秒二极管激光器。对于磷光寿命成像而言,一个用于激发磷光,另外一个则处于关闭状态。用像素同步的激光多路复用可以得到如图4左侧那样的调制机理。
图4显示了DCS-120共焦扫描仪的系统参数设置。“Laser Multiplexing”设为“Pixel”,同时把激光开启的像素时间设为12.5%。禁用自动选择扫描速率,把像素时间设置为比预计的磷光衰退时间略长。如果需要对一个相当长的衰减时间进行成像,我们需要扩展扫描速率的可用范围,这可以用设定“Scan Details”栏的“Max Line Time”来得到。
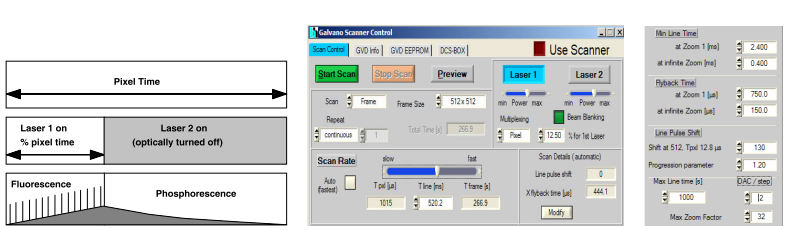
图4,DCS-120系统磷光衰减成像的扫描器控制参数。左图,激光调制和扫描速度控制的定义;右图,“Scan Details”定义了最大线时间。
对于其他的激光扫描显微镜而言,进行磷光寿命成像就意味着显微镜必须有一个控制激光调制的像素时钟输出。此外,显微镜还必须接收激光调制信号的输入来实现对其内部的挡光进行控制。我们用Becker&Hickl DDG-210可编程脉冲发生器来生成激光调制信号,我们通过像素时钟来触发DDG-210。如图5所示,我们通过可编程宽度的调制信号来反馈显微镜下的挡光系统,而第二路信号用来和TCSPC模块通信激光是否开启,TCSPC模块以此为依据来分别使用不同的存储模块来采集荧光或者磷光信号。通信信号为了适配显微镜里声光调制器(AOM)的延迟也有适当的延迟处理。

图5,非DCS-120扫描系统的开关调制激光。显微镜中的像素时钟控制DDG-120脉冲发生器内激光脉冲的产生。激光开启脉冲控制显微镜的挡光模块。显微镜的AOM对于挡光有略微的延迟,一个给SPC-150 TCSPC的信号指示了激光的开启。左图是连接情况,右图是激光脉冲图案。
结果
DCS-120共焦FLIM系统
图6和图7显示了一个用DCS-120共焦FLIM系统的磷光寿命成像的例子。图像是通过无机染料得到的。激发用的激光器是BDL-405 SMC,信号采集用的是带有DCS-120的Simple-Tau 152系统。
图6是SPCM数据采集软件所显示的图像,图7是用BH SPCImage FLIM分析软件得到的发光寿命结果。

图6,同时记录的荧光图像(左上)和磷光图像(左下)。右边分别是皮秒尺度上和微秒尺度上的衰减图像。用的是无机发光颗粒,BDL-405SMC激光器,Simple-Tau 152 FLIM系统,和SPCM数据采集系统。

图7,来自于图6的荧光寿命图像(左)和磷光寿命图像(右)。颜色从红到蓝分别表示了500 ps到4 ns和10到15 ms。用的数据分析软件是SPCImage。
蔡司LSM 710 NLO多光子显微镜
试验中同样可以使用双光子激发来同时得到荧光和磷光图像,我们选择了蔡司LSM 710 NLO多光子显微镜来做这个实验。激光的激发波长是780 nm,发光的扫描路径用的是LSM 710的非退扫描路径。光子检测使用的是Becker &Hickl的HPM-100-40混合探测器,记录用的是Becker&Hickl的SPC-150 TCSPC FLIM模块。激光调制原理用的是图5中的原理。
试验中我们使用了钌染料染色的酵母细胞。细胞被被养在装满水的细胞盘里,其中加入了少量的3- (2,2'-联吡啶) 钌 (II) 六水合物来作为磷光染料。
图8是我们得到的强度图像,按照TCSPC软件设定的参数不同我们可以从相同的数据里面得到不同的图像。左侧的图像显示了激光开启阶段的发光。这主要包括细胞的自发荧光以及一小部分钌染料的磷光。中间是激光关闭阶段的发射,这就仅仅包含了磷光。磷光主要来自于钌染料结合的细胞膜。右图则是左图和中图强度的集合。
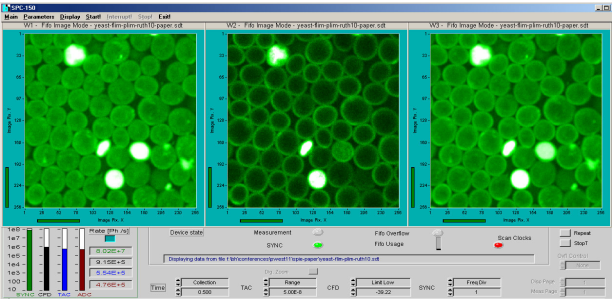
图8,用钌染料染色的酵母细胞的强度图像,从左到右,荧光图案,磷光图案以及发射光的总和。显微镜是LSM 710 NLO,用780nm的激光进行双光子激发,非退扫描,光子检测使用的是Becker &Hickl的HPM-100-40混合探测器,记录用的是Becker&Hickl的SPC-150 TCSPC FLIM模块。
图9是从同样的数据得来的寿命图像,左边是荧光寿命图像,右边是磷光寿命图像。图10是图像上特定点的衰减曲线。蓝点是时间通道内随后收集的光子数,红色曲线是通过双指数衰减模型拟合得到的结果,绿色的曲线是有效的仪器响应函数 (IRF)。请读者注意,荧光衰减曲线中的IRF包含有激光脉冲和探测器影响两个部分,而磷光衰减曲线的IRF仅仅包含有激光调制波形。

图9,用钌染料染色的酵母细胞的荧光寿命成像(左)和磷光寿命成像(右)。对于衰减曲线的分析使用的是双指数幅度权重寿命分析。
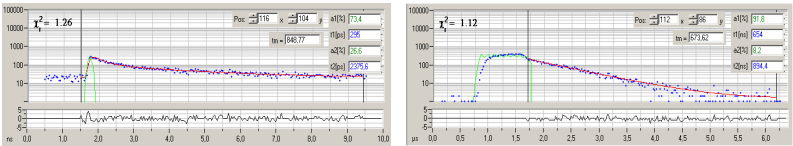
图10,图9所选点的荧光衰减曲线(左)和磷光衰减曲线(右)。蓝点是时间通道内随后收集的光子数,红色曲线是通过双指数衰减模型拟合得到的结果,绿色的曲线是有效的仪器响应函数 (IRF)。插入的是幅度权重发光寿命和双指数衰减参数。衰减参数对于荧光来说是ps级的,对于磷光来说是ns级的。
结论
上面所描叙的可以通过共焦或者多光子激光扫描系统同时记录荧光和磷光寿命成像的技术。它无需减少激光的重复频率,也无需使用高单个脉冲能量的激光。它可以和bh DCS 120 共焦扫描FLIM系统直接联用,如果开放对挡光装置的访问权限,它还可以与其他激光扫描显微镜联用。这项技术潜在的应用包括通过自体荧光代谢信号同步监测细胞的氧浓度,识别皮肤内的纳米粒子的防晒霜和化学产品,并观察这些粒子到皮肤深层或内部器官的可能迁移。
References
1. W. Becker, Advanced time-correlated single-photon counting techniques. Springer, Berlin, Heidelberg, New York, 2005
2. W. Becker, The bh TCSPC handbook. 3rd edition, Becker & Hickl GmbH (2008), available on www.becker-hickl.com
3. Becker & Hickl GmbH, DCS-120 Confocal Scanning FLIM Systems, user handbook. www.becker-hickl.com
4. Becker & Hickl GmbH, Modular FLIM systems for Zeiss LSM 510 and LSM 710 laser scanning microscopes. User handbook, available on www.becker-hickl.com
5. L.J. Charbonniere, N. Hildebrandt, Lanthanide complexes and quantum dots: A bright wedding for resonance energy transfer. Eur. J. Inorg. Chem. 2008, 3241-3251 (2008)
6. H.C. Gerritsen, R. Sanders, A. Draaijer, Y.K. Levine, Fluorescence lifetime imaging of oxygen in cells, J. Fluoresc. 7, 11-16 (1997)
7. J.R. Lakowicz, Principles of Fluorescence Spectroscopy, 3rd edn., Springer (2006)
8. A. Y. Lebedev, A. V. Cheprakov, S. Sakadzic, D. A. Boas, D. F. Wilson, Sergei A. Vinogradov, Dendritic Phosphorescent Probes for Oxygen Imaging in Biological Systems. Applied Materials & Interfaces 1, 1292-1304 (2009)
9. E. Roussakis, M. A. Yaseen, E. T. Mandeville, V. J. Srinivasan1, K. Arai, S. Ruvinskaya, A. Devor, E. H. Lo, S. A. Vinogradov, D. A. Boas, Two-photon high-resolution measurement of partial pressure of oxygen in cerebral vasculature and tissue. Nature Methods 7(9) 755-759
10. M. Shibata, S. Ichioka, J. Ando, A. Kamiya, Microvascular and interstitial PO2 measurement in rat skeletal muscle by phosphorescence quenching. J. Appl. Physiol. 91, 321-327 (2001)
(翻译: 北京鼎信优威光子科技有限公司 汪 阳 博士)









